本试题 “某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:(1)当m=l时,测定0.1 mol/L HA的pH值,若测得0.1mol/L HA的pH=2,...” 主要考查您对弱电解质电离的影响因素
弱电解质的电离度
弱电解质的电离
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质电离的影响因素
- 弱电解质的电离度
- 弱电解质的电离
电离平衡的影响因素:
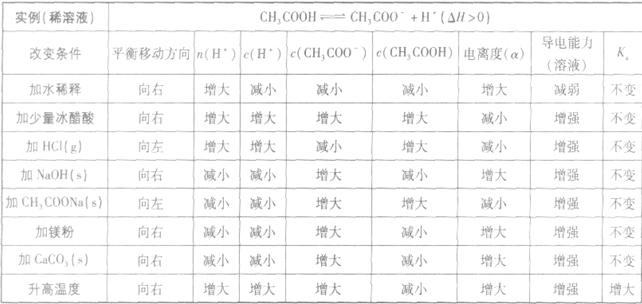
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:

电离度:
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
发现相似题
与“某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下...”考查相似的试题有:
- 下列说法不正确的是[ ]A.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H
- 下列溶液中加入少量NaOH固体导电能力变化不大的是A.盐酸B.CH3COOHC.NH3·H2OD.H2O
- 物质的量浓度相同的下列物质的水溶液,酸性最强的是A.HClB.H2SO4C.CH3COOHD.NaCl
- 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。据图判断正确的是( )A.Ⅱ为盐酸...
- 下列说法中,正确的是A.强电解质的水溶液一定比弱电解质的水溶液的导电能力强B.强电解质都是离子化合物,弱电解质都是共价...
- 25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是( )A.I和II中H2O的电离程度不相等B.将I稀释l0倍,...
- 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )A.溶液中导电粒子的数目减少B.溶液中不变C.醋酸的电离...
- 下列实验事实不能证明醋酸是弱酸的是( )A.常温下,测得醋酸钠溶液的pH>7B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4C.常温...
- 区分强电解质和弱电解质的依据是 A.溶解度的大小B.属于离子化合物还是共价化合物C.在水溶液中是否存在电离平衡D.溶液导电...
- 下列物质在水中部分电离且属于电解质的是( )A.NaOHB.CH3COOHC.H2SO4D.CO2