探究二氧化碳的三个性质实验:
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性
3.二氧化碳能溶于水
二氧化碳性质探究实验:
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧(1)装置:
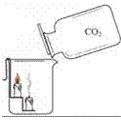
(2)现象:蜡烛由低到高依次熄灭
结论:证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性(1)装置:

(2)现象:1和4实验中的白花变红,2和3白花不变色
(3)结论:二氧化碳不能使紫色石蕊试液变红,二氧化碳的水溶液能使紫色石蕊试液变红。
(或二氧化碳溶于水显酸性)
3.二氧化碳能溶于水(1)装置:
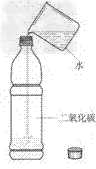
(2)现象:塑料瓶变瘪
(3)结论:二氧化碳能溶于水。
金属的化学性质:
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:1.
金属和氧气的反应
| 金属 |
在空气中 |
在氧气中 |
方程式 |
| 镁 |
常温下表面逐渐变暗。点燃
剧烈燃烧,发出耀眼的白光,
生成白色固体 |
点燃,剧烈燃烧,发出耀
眼的白光,生成白色固体 |
2Mg+O2 2MgO 2MgO |
| 铝 |
常温下,铝表而变暗,生成一
层致密氧化膜,保护铝不再被腐蚀 |
点燃。剧烈燃烧,火星四射,
放出大量的热,生成白色固体 |
4Al+3O2 2Al2O3 2Al2O3 |
| 铁 |
持续加热发红,离火变冷 |
火星四射,放出大量的热,
生成黑色固体 |
3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 |
加热,生成黑色物质,在潮湿的
空气中,生成铜绿而被腐蚀 |
加热,生成黑色固体 |
2Cu+O2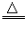 2CuO 2CuO |
| 金 |
即使在高温也不和氧气反应 |
|
—— |
| 结论 |
大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 |
|
2.
金属与酸的反应
|
盐酸 |
稀硫酸 |
反应现象(两种酸中相同) |
| 镁 |
Mg+2HCl==MgCl2+H2↑ |
Mg+H2SO4==MgSO4+H2↑ |
反应比较剧烈,产生大量
气泡,溶液仍为无色,生成
的气体能够燃烧,并且产
生淡蓝色火焰 |
| 铝 |
2Al+6HCl==2AlCl3+3H2↑ |
2Al+3H2SO4==Al2(SO4)+3H2↑ |
| 锌 |
Zn+2HCl==H2↑+ZnCl2 |
Zn+H2SO4==ZnSO4+H2↑ |
反应缓慢,有气泡产生,溶
液由无色逐渐变为浅绿色,
生成的气体能够燃烧,并且
产生淡蓝色火焰 |
| 铁 |
Fe+2HCl==FeCl2+H2↑ |
Fe+H2SO4==FeSO4+H2↑ |
| 铜 |
不反应 |
不反应 |
无 |
3.
金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
|
CuSO4溶液 |
AgNO3溶液 |
NaCl溶液 |
| 锌 |
锌表面有一层红色金属析出,溶液由蓝色变为无色
Zn+CuSO4==ZnSO4+Cu |
锌表面有一层银白色金属析出
Zn+2AgNO3==Zn(NO3)2+2Ag |
无变化,不反应 |
| 铁 |
铁表面有一层红色金属析出,溶液由蓝色变为浅绿色
Fe+CuSO4==FeSO4+Cu |
铁表面有一层银白色金属析出,溶液由无色变为浅绿色
Fe+2AgNO3==Fe(NO3)2+2Ag |
无变化,不反应 |
| 铜 |
无变化,不反应 |
铜表面有一层银白色金属析出,溶液由无色变为蓝色
Cu+2AgNO3==Cu(NO3)2+2Ag |
无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe
2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H
2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
定义:
金属活动性指金属单质在水溶液中失去电子生成金属阳离子的性质。
常见金属活动性顺序: K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
金属活动性顺序表的意义 (1)金属的位置越靠前,它的活动性越强
(2)位于氢前面的金属能置换出酸中的氢(强氧化酸除外)。
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。
(4)很活泼的金属,如K、Ca、Na与盐溶液反应,先与溶液中的水反应生成碱,碱再与盐溶液反应,没有金属单质生成。如:
2Na+CuSO
4+2H
2O==Cu(OH)
2↓+Na
2SO
4+H
2↑
(5)不能用金属活动性顺序去说明非水溶液中的置换反应,如氢气在加热条件下置换氧化铁中的铁:
Fe
2O
3+3H
2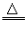
2Fe+3H
2O
金属原子与金属离子得失电子能力的比较
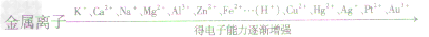
金属活动性顺序表的应用 (1)
判断某些置换反应能否发生 a.判断金属与酸能否反应:
条件:
①金属必须排在氢前面
②酸一般指盐酸或稀硫酸
b.判断金属与盐溶液能否反应:
条件:
①单质必须排在盐中金属的前面
②盐必须可溶于水
③金属不包含K、Ca、Na
(2)
根据金属与盐溶液的反应判断滤液、滤渣的成分。如向CuSO
4,AgNO
3混合液中加铁粉,反应后过滤,判断滤液和滤渣成分。铁与CuSO
4和AgNO
3溶液反应有先后顺序,如果铁足量,先将AgNO
3中的Ag完全置换后再置换CuSO
4中的Cu,那么溶液中只有FeSO
4;如果铁的量不足,应按照“先后原则”分别讨论滤液和滤渣的成分。
(3)根据金属活动性顺序表判断金属与酸反应的速率或根据反应速率判断金属的活动性顺序。如镁、锌、铁三种金属与同浓度的稀H
2SO
4反应产生氢气的速率:Mg>Zn>Fe,则可判断金属活动性Mg>Zn>Fe,
(4)
利用金属活动性顺序表研究金属冶炼的历史。金属活动性越弱,从其矿物中还原出金属单质越容易; 金属活动性越强,从其矿物中还原出金属单质越难。所以越活泼的金属越不易冶炼,难于冶炼的金属开发利用的时间就越迟。
(5)
应用举例 a.湿法炼铜我国劳动人民在宋代就掌握了湿法炼铜技术,即将铁放入硫酸铜溶液中置换出铜: Fe+CuSO
4=FeSO
4+Cu。
b.从洗相废液中回收银洗相废掖中含有大量的硝酸银,可用铁置换回收: Fe+2AgNO
3==Fe(NO
3)
2+2Ag。
c.处理工业废水中的铜、汞离子工业废水中常含铜、汞等金属离子,这些离子对生物有很大的危害,在排放前必须进行处理,可用铁置换回收:Fe+CuSO
4==FeSO
4+Cu
d.实验室选择金属与酸反应制取氢气在金属活动性顺序表中,H之前的金属都能跟稀 H
2SO
4、稀HCl反应产生氢气,但Zn之前的金属与酸反应太快。不便操作;Zn之后的金属与酸反应太慢,花费时间太长,从经济效益和反应速率多方而考虑,Zn是最合适的金属。
金属与混合溶液的反应 (1)将一种金属单质放入几种金属的盐溶液的混合液中时,其中排在金属活动性顺序表巾最靠后的金属最先被置换出来,然后再依次置换出稍靠后的金属。简记为“在金属活动性顺序中,距离远,先反应”。如将金属Zn。放入FeSO
4和CuSO
4的混合溶液中,Zn先与CuSO
4发生置换反应,与CuSO
4反应完后再与FeSO
4 发生置换反应。根据金属锌的最不同可分为以下几种情况:
| 金属锌的量 |
析出金属 |
滤液的成分 |
| 锌不足(不能与CuSO4溶液完全反应) |
Cu |
ZnSO4、FeSO4、CuSO4 |
| 锌不足(恰好与CuSO4溶液完全反应) |
Cu |
ZnSO4、FeSO4 |
| 锌不足(不能与FeSO4溶液完全反应) |
Fe、Cu |
ZnSO4、FeSO4 |
| 锌适量(恰好与FeSO4溶液完全反应) |
Fe、Cu |
ZnSO4 |
| 锌足量 |
Zn、Fe、Cu |
ZnSO4 |
(2)将几种不同的金属放入同一种盐溶液中,发生反应的情况与将一种金属放入几种金属的盐溶液中相似,也是在金属活动性顺序表中,距离越远的先反应,然后是距离较远的反应。
金属与酸反应生成氢气图像问题的分析方法:(1)等质氢图:两种金属反应产生的氢气质量相同,此图反映两种情况:

①酸不足,金属过虽,产生的氢气质量由酸的质量决定。
②酸足量,投放的两种金属与酸反应产生氢气的质量恰好相同,如6.5g锌和5.6g铁分别投入足量的盐酸中反应产生的氢气质量相同。
(2)等质等价金属图:如等质量的镁、铁、锌与足量的酸反应生成的金属离子都是+2价,产生氢气的速率和质量不同。此图反映出:

①金属越活泼,图示反应物的线越陡,如Mg线比Zn线陡,Zn线比Fe线陡,说明活泼性Mg>Zn>Fe
②金属的相对原子质量越小。等质量时,与酸反应产生的氢气越多,曲线的拐点越高,因此,相对原子质量Zn >Fe>Mg。
可简单概括为:越陡越活,越高越小。
(3)等质不等价金属图:铝、镁、锌与酸反应生成金属离子的化合价分别为+3、+2、+2,此图反映出等质不等价金属与酸反应不仅速率不同而且生成的氢气的质量与金属化合价有关。
可用下面式子计算氢气质量:

 金属与酸或盐溶液反应前后溶液密度变化的判断方法:
金属与酸或盐溶液反应前后溶液密度变化的判断方法:金属与酸的反应和金属与盐溶液的反应均为置换反应,反应后溶液的溶质发生了改变,导致溶液的溶质质量分数、溶液的密度也随之改变。反应前后溶液的密度的变化取决于反应前后溶液中溶质的相对分子质量的相对大小。
(1)反应后溶液密度变小:如Fe+CuSO
4== FeSO
4+Cu,在该反应中,反应前溶液中的溶质为CuSO
4,其相对分子质量为160;反应后溶液中的溶质为FeSO
4,其相对分子质量为152,由于152<160,故该反应后溶液密度变小。
(2)反应后溶液密度变大:如Zn+H
2SO
4== ZnSO
4+H
2↑,在该反应中,反应前溶液中的溶质为H
2SO
4,相对分子质量为98;反应后溶液中溶质为ZnSO
4,相对分子质童为161,由于161>98。故该反应后溶液密度变大。
真假黄金的鉴别:
黄金是一种具有金黄色光泽的金属、化学性质极不活泼。黄铜的外形与黄金非常相似,所以不法分子常用黄铜(Zn,Cu合金)来冒充黄金。但二者之间的性质有很大差异,可用多种方法鉴别。
方法一:取少量金黄色金属块于试管中,加入少量稀盐酸或稀硫酸,若有气泡产生(Zn+2HCl==ZnCl
2 +H
2),则原试样为黄铜;若没有气泡产生,则原试样为黄金。
方法二:取少量金黄色金属块,用天平称其质量,用量筒和水测出其体积,计算出金属块的密度与黄金的密度对照,若密度相等,则为黄金;若有较大的差异,则为黄铜。
方法三:取少员金黄色金属块在火焰上加热,若金属块表面变黑(2Cu+O
2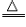
2CuO,则原试样为黄铜;若无变化,则为黄金。
方法四:取少讨金黄色金属块于试管中,向试管中加人适量的硫酸铜溶液,若金属块表而出现红色物质且溶液颜色变浅(Zn+CuSO
4==ZnSO
4+Cu),则原试样为黄铜;若无变化,则原试样为黄金。