本试题 “下列说法正确的是[ ]A.某无色溶液滴加酚酞试液变红色,则该溶液一定是碱溶液B.某溶液中滴加氯化钡溶液有不溶于稀硝酸的白色沉淀生成,该溶液中一定含硫酸根...” 主要考查您对饱和溶液,不饱和溶液
酸碱指示剂
中和反应及在实际中的应用
离子的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 饱和溶液,不饱和溶液
- 酸碱指示剂
- 中和反应及在实际中的应用
- 离子的检验
饱和溶液和不饱和溶液的概念:
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液 不饱和溶液
不饱和溶液
(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水 不饱和石灰水
不饱和石灰水
概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)
溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液 饱和溶液
饱和溶液
溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)
溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液 不饱和溶液
不饱和溶液
溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
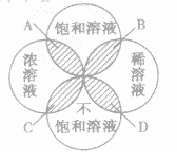 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液
 不饱和溶液
不饱和溶液(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水
 不饱和石灰水
不饱和石灰水概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液
 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液
 饱和溶液
饱和溶液溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液
 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液
 不饱和溶液
不饱和溶液溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
酸碱指示剂:
跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
紫色石蕊试液和无色酚酞试液的显色:
紫色石蕊试液和无色酚酞试液是两种常用的酸碱指示剂,它们与酸性、碱性溶液作用时显示的颜色见下表:
易错点:
①变色的是指示剂,而不是酸或碱的溶液。如盐酸使紫色石蕊试液变红,不能说成紫色石蕊试液使盐酸变红,但可以说紫色石蕊试液遇盐酸变红。
②酸或碱的溶液能使紫色石蕊试液或酚酞试液变色,但能使紫色石蕊试液或酚酞试液变色的不一定是酸或碱的溶液,还可能是酸性盐溶掖或碱性盐溶液。如碳酸钠溶液能使紫色石蕊试液变蓝,但碳酸钠不是碱,而是盐。
酸碱指示剂的代用品:
在自然界里,有许多植物色素在不同的酸碱性溶液中.都会发生特定的颜色变化。这些植物色素可以用作石蕊和酚酞等指示剂的代用品。一些植物的色素及其在酸碱性溶液中的颜色变化如下:
跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
紫色石蕊试液和无色酚酞试液的显色:
紫色石蕊试液和无色酚酞试液是两种常用的酸碱指示剂,它们与酸性、碱性溶液作用时显示的颜色见下表:
| 酸性溶液 | 碱性溶液 | 中性溶液 | |
| 石蕊试液 | 红 | 蓝 | 紫 |
| 酚酞试液 | 无 | 红 | 无 |
易错点:
①变色的是指示剂,而不是酸或碱的溶液。如盐酸使紫色石蕊试液变红,不能说成紫色石蕊试液使盐酸变红,但可以说紫色石蕊试液遇盐酸变红。
②酸或碱的溶液能使紫色石蕊试液或酚酞试液变色,但能使紫色石蕊试液或酚酞试液变色的不一定是酸或碱的溶液,还可能是酸性盐溶掖或碱性盐溶液。如碳酸钠溶液能使紫色石蕊试液变蓝,但碳酸钠不是碱,而是盐。
酸碱指示剂的代用品:
在自然界里,有许多植物色素在不同的酸碱性溶液中.都会发生特定的颜色变化。这些植物色素可以用作石蕊和酚酞等指示剂的代用品。一些植物的色素及其在酸碱性溶液中的颜色变化如下:
| 代用指示剂的颜色 | |||
| 在酸性溶液中 | 在中性溶液中 | 在碱性溶液中 | |
| 牵牛花 | 红色 | 紫色 | 蓝色 |
| 苏木 | 黄色 | 红棕色 | 玫瑰红色 |
| 紫萝卜皮 | 红色 | 紫色 | 黄绿色 |
| 月季花 | 浅红色 | 红色 | 黄色 |
| 美人蕉 | 淡红色 | 红色 | 绿色 |
中和反应:
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
定义:
判断溶液中阴阳离子的存在情况。
几种常见离子的检验
常见酸、碱、盐的检验:
检验中的干扰和排除
在物质的检验过程中,由于待检物质中混有杂质、选用试剂不当或试剂不纯,包括仪器不清净、操作有误等.都会对检验造成干扰,应当予以排除。如鉴定CO32- 和SO42-共存时,我们不应该选用硝酸银试剂,而应选用硝酸钡或氯化钡试剂。再如,当CO32-和SO42-共存时,我们要检验出SO42-,则应先加盐酸酸化,排除CO32-离了的干扰后,再用氯化钡试剂进行检验。
检验结果的分析和判断
根据检验过程中所观察到的观象确定试样中存在哪些离子,必须把可能存在的离子全部考虑到,再根据每步检验的现象,肯定或否定某些离子的存在,逐步缩小范围,最终得出正确的结论。
判断溶液中阴阳离子的存在情况。
几种常见离子的检验
| 离子 | 所用试剂 | 方法 | 现象 | 化学方程式 |
| Cl- | AgNO3溶液和稀HNO3 | 将AgNO3溶液滴入待测液中,再加稀HNO3 | 生成白色沉淀.且不溶于稀HNO3 | AgNO3+NaCl==AgCl↓+NaNO3 |
| SO42- | BaCl2溶液和稀盐酸 | 将稀盐酸滴入待测液中,再加BaCl2溶液 | 滴加稀盐酸无现象,滴加 BaCl2溶液生成白色沉淀,且沉淀不溶于稀盐酸 | BaCl2+Na2SO4==BaSO4↓+ +2NaCl |
| CO32- | 盐酸(或HNO3) 和澄清石灰水 | 向待测液中加入盐酸(或HNO3).将产生的气体通入澄清石灰水中 | 产生无色无味的气体,此气体能使澄清的石灰水变浑浊 | Na2CO3+2HCl==2NaCl+H2O+ CO2↑ CO2+Ca(OH)2==CaCO3↓+H2O |
| OH- | 酚酞试液、紫色石蕊试液或红色石蕊试纸 | ①将酚酞试液滴入待测液中 ②将紫色石蕊试液滴入待测液中 ③将待测液滴在红色石蕊试纸上 |
①溶液变红 ②溶液变蓝 ③红色石蕊试纸变蓝 |
—— |
| H+ | 紫色石蕊试液或蓝色石蕊试纸 | ①将紫色石蕊试液滴入待测液中 ②将待测液滴在蓝色石蕊试纸上 |
①溶液变红 ②蓝色石蕊试纸变红 |
—— |
| NH4+ | 浓NaOH溶液 | 将浓NaOH溶液加入待测液中,加热,将湿润的红色石蕊试纸置于试管口(或用玻璃棒蘸浓盐酸置于试管口) | 放出有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝(或遇到浓盐酸产生大量白烟) | NH4Cl+NaOH NaCl+H2O+NH3↑ NaCl+H2O+NH3↑ |
| Cu2+ | NaOH溶液 | 将NaOH溶液加入待测液中 | 生成蓝色沉淀 | CuSO4+2NaOH==Cu(OH)2↓ |
| Fe3+ | NaOH溶液 | 将NaOH溶液加入待测液中 | 生成蓝色沉淀 | FeCl3+3NaOH==Fe(OH)3↓+3NaCl |
常见酸、碱、盐的检验:
| 物质 | 检验方法 | 实验现象 | 典型化学式 |
| 硫酸及可溶性硫酸盐 | 取少量待检验溶液于试管中 (1)滴入紫色石蕊试液 (2)滴人稀盐酸和BaCl2溶液[或 Ba(NO3)2溶液] |
(1)溶液变红 (2)加入稀盐酸无明显现象,再加入BaCl2溶液有自色沉淀生成 |
H2SO4+BaCl2==BaSO4↓+2HCl Na2SO4+Ba(NO3)2==BaSO4↓+2NaNO3 |
| 盐酸及可溶性盐酸盐 | 取少量待检验溶液于试管中 (1)滴入紫色石蕊试液 (2)滴人AgNO3溶液和稀硝酸 |
(1)溶液变红 (2)有白色沉淀生成,且该沉淀不溶于稀硝酸 |
HCl+AgNO3=AgCl↓+HNO3 NaCl+AgNO3==AgCl↓+NaNO3 |
| 碳酸盐及碳酸氢盐 | 取少量待检验溶液于试管中 (1)加稀盐酸或稀硝酸 (2)将生成的气体通入澄清的石灰水中。 |
有气体生成,且该气体使澄清的石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 铵盐 | 将铵盐与碱混合共热 | 有刺激性气味气体生成 | NH4Cl+NaOH NaCl+NH3↑+H2O NaCl+NH3↑+H2O |
检验中的干扰和排除
在物质的检验过程中,由于待检物质中混有杂质、选用试剂不当或试剂不纯,包括仪器不清净、操作有误等.都会对检验造成干扰,应当予以排除。如鉴定CO32- 和SO42-共存时,我们不应该选用硝酸银试剂,而应选用硝酸钡或氯化钡试剂。再如,当CO32-和SO42-共存时,我们要检验出SO42-,则应先加盐酸酸化,排除CO32-离了的干扰后,再用氯化钡试剂进行检验。
检验结果的分析和判断
根据检验过程中所观察到的观象确定试样中存在哪些离子,必须把可能存在的离子全部考虑到,再根据每步检验的现象,肯定或否定某些离子的存在,逐步缩小范围,最终得出正确的结论。
发现相似题
与“下列说法正确的是[ ]A.某无色溶液滴加酚酞试液变红色,则该...”考查相似的试题有:
- 饱和溶液与不饱和溶液不是绝对的,在一定的条件下可以相互进行转化.请将实现转化的方法填在横线上.(1)由硝酸钾饱和溶液变...
- 下图是a、b两种固体物质的溶解度曲线。从图中可获得的信息是[ ]A.固体物质的溶解度均随温度升高而增大B.t℃,相同质量的a、b...
- 下图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:(1)t1℃时,甲物质的溶解度_________乙物质的溶解度(填“>”、“...
- 2003年10月15日我国载人飞船神舟五号成功发射升空,于16日胜利返回.在宇宙飞船的太空实验室中,进行下列实验,其中最难完成...
- 要借助酸碱指示剂才能判断反应进行情况的是( )A.稀硫酸和氧化铁B.稀盐酸和氢氧化铜C.稀盐酸和氢氧化钠溶液D.硫酸铜溶液...
- 化学就在我们身边,下面是厨房里常用的化学物质,用它们的序号填空.①食醋 ②纯碱 ③天然气属于化石燃料的是______,能使石蕊溶...
- 了解物质构成的微观奥秘,能帮助我们更好地认识物质变化的本质。(1)下列有关原子的结构说法正确的是____(填序号)。A.原子...
- 向氢氧化钠溶液中逐滴滴加稀盐酸,并用pH试纸检测其酸碱度.当pH=10时溶液中的溶质为______;当pH=7时溶液中的溶质为______;...
- 某同学学习了溶液酸碱度的表示方法——pH之后,对家中的一些食品及生活用品进行了 pH测定,结果如下。参照下图,下列说法正确的...
- (2011年·衡阳)酸碱中和反应在工农业生产和日常生活中应用十分广泛。如下图所示是氢氧化钠与稀盐酸反应的实验示意图。请据图...