本试题 “身边处处有化学,它与我们的生活、学习密切相关.请你选用下列物质填空 (填序号):①小苏打 ②酒精 ③食醋 ④活性炭 ⑤氯化钠(1)用于除去冰箱异味的是______;...” 主要考查您对乙醇
有机化合物和无机化合物
碳的性质
酸的用途
碱的用途
盐的用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乙醇
- 有机化合物和无机化合物
- 碳的性质
- 酸的用途
- 碱的用途
- 盐的用途
定义:
乙醇的结构简式为C2H5OH,俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。乙醇的用途很广,可用乙醇来制造醋酸、饮料、香精、染料、燃料等。医疗上也常用体积分数为70%——75%的乙醇作消毒剂等。
性状:无色透明液体(纯酒精),有特殊香味的气味,易挥发。能与水、氯仿、乙醚、甲醇、丙酮和其他多数有机溶剂混溶,相对密度(d15.56)0.816,易燃,蒸气能与空气形成爆炸性混合物。
危险特征:本品易燃,其蒸气与空气可形成爆炸性混合物。遇明火、高热能引起燃烧爆炸。与氧化剂接触发生化学反应或引起燃烧。在火场中,受热的容器有爆炸的危险。其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。
乙醇的性质:
1. 物理性质:性状无色透明、易燃易挥发液体。有酒的气味和刺激性辛辣味。
熔点-117.3℃
沸点78.32℃
相对密度0.7893
闪点14℃
溶解性溶于水、甲醇、乙醚和氯仿。能溶解许多有机化合物和若干无机化合物。
2. 化学性质:
氧化反应
(1)燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
不完全燃烧:2C2H5OH+5O2 2CO2+2CO+6H2O
2CO2+2CO+6H2O
安全措施:
泄漏:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄露:用砂土或其它不燃材料吸附或吸收。也可用大量水冲洗,洗水稀释后放入废水系统。
大量泄露:构筑围堤或挖坑收容;用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
灭火方法:
燃烧性:极易燃
灭火剂:抗溶性泡沫、干粉、二氧化碳、砂土。
灭火注意事项:尽可能将容器从火场移至空旷处。喷水保持容器冷却,直至灭火结束。
紧急处理:
吸入:迅速脱离现场至新鲜空气,若现象严重要尽快就医。
误食:饮足量温水,催吐。若现象严重要尽快就医。
皮肤接触:脱去被污染衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。若现象严重要尽快就医。
实验室使用及灭火
(1)应使用火柴点燃,否则容易使酒精灯内的酒精燃烧。
(2)使用完毕后,应用灯帽将火盖灭。
(3)如不慎将酒精洒出并引燃,则应用湿抹布将其盖灭。
乙醇的用途:
溶剂;有机合成;各种化合物的结晶;洗涤剂;萃取剂;食用酒精可以勾兑白酒;用作粘合剂;硝基喷漆;清漆、化妆品、油墨、脱漆剂等的溶剂以及农药、医药、橡胶、塑料、人造纤维、洗涤剂等的制造原料、还可以做防冻剂、燃料、消毒剂等。 75%(体积分数)的乙醇溶液常用于医疗消毒。
乙醇和甲醇的区别:
①甲醇是甲烷的一个氢原子被羟基(一个氢和一个氧组成的原子团,不是氢氧根)替换后的产物。
乙醇是乙烷一个氢原子被羟基替换后的产物,俗称酒精。
②分子式不一样。
甲醇:CH3OH
乙醇:CH3CH2OH
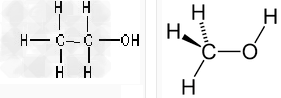
乙醇结构 甲醇结构
他们的分子式不一样,化学性质和物理性质也有区别。
③工业酒精里常含有甲醇,甲醇有毒,不能用工业酒精配制酒
乙醇汽油:
乙醇汽油也被称为(E型汽油),我国使用乙醇汽油是用90%的普通汽油与10%的燃料乙醇调和而成。它可以改善油品的性能和质量,降低一氧化碳、碳氢化合物等主要污染物排放。
乙醇的结构简式为C2H5OH,俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。乙醇的用途很广,可用乙醇来制造醋酸、饮料、香精、染料、燃料等。医疗上也常用体积分数为70%——75%的乙醇作消毒剂等。
性状:无色透明液体(纯酒精),有特殊香味的气味,易挥发。能与水、氯仿、乙醚、甲醇、丙酮和其他多数有机溶剂混溶,相对密度(d15.56)0.816,易燃,蒸气能与空气形成爆炸性混合物。
危险特征:本品易燃,其蒸气与空气可形成爆炸性混合物。遇明火、高热能引起燃烧爆炸。与氧化剂接触发生化学反应或引起燃烧。在火场中,受热的容器有爆炸的危险。其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。
乙醇的性质:
1. 物理性质:性状无色透明、易燃易挥发液体。有酒的气味和刺激性辛辣味。
熔点-117.3℃
沸点78.32℃
相对密度0.7893
闪点14℃
溶解性溶于水、甲醇、乙醚和氯仿。能溶解许多有机化合物和若干无机化合物。
2. 化学性质:
氧化反应
(1)燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O 不完全燃烧:2C2H5OH+5O2
 2CO2+2CO+6H2O
2CO2+2CO+6H2O安全措施:
泄漏:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄露:用砂土或其它不燃材料吸附或吸收。也可用大量水冲洗,洗水稀释后放入废水系统。
大量泄露:构筑围堤或挖坑收容;用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
灭火方法:
燃烧性:极易燃
灭火剂:抗溶性泡沫、干粉、二氧化碳、砂土。
灭火注意事项:尽可能将容器从火场移至空旷处。喷水保持容器冷却,直至灭火结束。
紧急处理:
吸入:迅速脱离现场至新鲜空气,若现象严重要尽快就医。
误食:饮足量温水,催吐。若现象严重要尽快就医。
皮肤接触:脱去被污染衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。若现象严重要尽快就医。
实验室使用及灭火
(1)应使用火柴点燃,否则容易使酒精灯内的酒精燃烧。
(2)使用完毕后,应用灯帽将火盖灭。
(3)如不慎将酒精洒出并引燃,则应用湿抹布将其盖灭。
乙醇的用途:
溶剂;有机合成;各种化合物的结晶;洗涤剂;萃取剂;食用酒精可以勾兑白酒;用作粘合剂;硝基喷漆;清漆、化妆品、油墨、脱漆剂等的溶剂以及农药、医药、橡胶、塑料、人造纤维、洗涤剂等的制造原料、还可以做防冻剂、燃料、消毒剂等。 75%(体积分数)的乙醇溶液常用于医疗消毒。
乙醇和甲醇的区别:
①甲醇是甲烷的一个氢原子被羟基(一个氢和一个氧组成的原子团,不是氢氧根)替换后的产物。
乙醇是乙烷一个氢原子被羟基替换后的产物,俗称酒精。
②分子式不一样。
甲醇:CH3OH
乙醇:CH3CH2OH

乙醇结构 甲醇结构
他们的分子式不一样,化学性质和物理性质也有区别。
③工业酒精里常含有甲醇,甲醇有毒,不能用工业酒精配制酒
乙醇汽油:
乙醇汽油也被称为(E型汽油),我国使用乙醇汽油是用90%的普通汽油与10%的燃料乙醇调和而成。它可以改善油品的性能和质量,降低一氧化碳、碳氢化合物等主要污染物排放。
有机化合物:
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
有机化合物与无机化合物的主要区别:
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
氧化物,酸,碱,盐的比较:
| 物质类别 | 概念 | 分类 |
| 氧化物 | 由两种元素组成,期中一种是氧元素 | 金属氧化物:由金属元素与氧元素组成,如MgO,Fe2O3等 非金属氧化物:由非金属元素与氧元素组成,如CO2、SO2、H2O等 |
| 酸 | 能离解成氢离子和酸根离子的化合物 | 含氧酸:如H2SO4、H2CO3、HNO3等无氧酸:如HCl,H2S等 |
| 碱 | 由金属离子和氢氧根离子构成的化合物 | 可溶性碱:如NaOH,Ca(OH)2等不溶性碱:如Mg(OH)2、 Fe(OH)3等 |
| 盐 | 由金属离子(或铵根离子)和酸根离子构成的化合物 | 正盐:如NaCl、NH4Cl、Na2CO3,仅由金属离子或钱根离子和酸根离子两部分组成酸式盐:如NaHCO3、NH4HCO3,由金属离子或铵根离子、酸式酸根离子构成碱式盐;如Cu2(OH)2CO3,由金属离子、酸根离子和氢氧根离子构成 |
有机化合物与无机化合物的主要区别:
| 有机化合物 | 无机化合物 | |
| 溶解性 | 多数不溶于水。易溶于有机溶剂 | 有些溶于水而不溶于有机溶剂 |
| 耐热性 | 多数不耐热。熔点较低,一般在400℃ 以下 | 多数耐热,难熔化,熔点一般比较高 |
| 可燃性 | 多数可以燃烧 | 多数不能燃烧 |
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
概述:
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2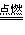 CO2
CO2
氧气不充分的条件下:2C+O2 2CO
2CO
3.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2 CO2
CO2
氧气量不充足时,碳不充分燃烧:2C+O2 2CO
2CO
mg碳与ng氧气反应:
①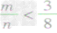 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;
②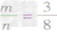 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2;
③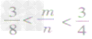 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;
④ 时,恰好完全反应生成CO;
时,恰好完全反应生成CO;
⑤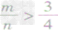 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。
碳单质及其化合物间的转化:
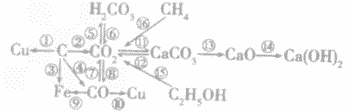
(1)C+2CuO 2Cu+CO2↑
2Cu+CO2↑
(2)C+O2 CO2
CO2
(3)3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
(4)2C+O2 2CO
2CO
(5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2 2CO2
2CO2
(8)C+CO2 2CO
2CO
(9)3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
(10)CO+ 2CuO 2Cu + CO2
2Cu + CO2
(11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3 CaO+CO2
CaO+CO2
(14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
(16)CH4+O2 CO2+2H2O
CO2+2H2O
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2
 CO2
CO2 氧气不充分的条件下:2C+O2
 2CO
2CO 3.还原性:
木炭还原氧化铜:C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ 焦炭还原四氧化三铁:2C+Fe3O4
 3Fe+2CO2↑
3Fe+2CO2↑ 木炭与二氧化碳的反应:C+CO2
 CO
CO 碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2
 CO2
CO2 氧气量不充足时,碳不充分燃烧:2C+O2
 2CO
2CO mg碳与ng氧气反应:
①
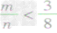 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;②
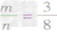 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2; ③
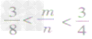 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;④
 时,恰好完全反应生成CO;
时,恰好完全反应生成CO; ⑤
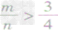 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。 碳单质及其化合物间的转化:

(1)C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ (2)C+O2
 CO2
CO2(3)3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ (4)2C+O2
 2CO
2CO (5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2
 2CO2
2CO2 (8)C+CO2
 2CO
2CO(9)3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 (10)CO+ 2CuO
 2Cu + CO2
2Cu + CO2 (11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3
 CaO+CO2
CaO+CO2 (14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O(16)CH4+O2
 CO2+2H2O
CO2+2H2O酸的用途很广泛:
1. 盐酸:用于金属表面除锈,制造药物等,人体胃液中含有盐酸帮助消化。
2. 硫酸:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等;实验室常用作干燥剂。
3. 硝酸:主要应用于制造化肥,以及硝酸盐工业。
4. 醋酸:生活中既可作食品调味,也可用于清洗热水瓶内水垢。
1. 盐酸:用于金属表面除锈,制造药物等,人体胃液中含有盐酸帮助消化。
2. 硫酸:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等;实验室常用作干燥剂。
3. 硝酸:主要应用于制造化肥,以及硝酸盐工业。
4. 醋酸:生活中既可作食品调味,也可用于清洗热水瓶内水垢。
常见的碱的用途:
1. 氢氧化钠:是重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业。实验室中可作干燥剂。
2. 氢氧化钙:用于建筑业,制漂白粉,改良土壤。常用于实验室二氧化碳的检验。
1. 氢氧化钠:是重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业。实验室中可作干燥剂。
2. 氢氧化钙:用于建筑业,制漂白粉,改良土壤。常用于实验室二氧化碳的检验。
常见盐的用途:
1. 氯化钠(NaCl):作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料碳酸钠(Na2CO3):制烧碱,广泛用于玻璃、纺织、造纸等
2. 碳酸氧钠(NaHCO3):工业焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多
3. 碳酸钙(CaCO3):实验室制取CO2,重要的建筑材料,制补钙剂
4. 硫酸铜(CuSO4): 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜
5. 高锰酸钾(KMnO4):常作消毒剂
1. 氯化钠(NaCl):作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料碳酸钠(Na2CO3):制烧碱,广泛用于玻璃、纺织、造纸等
2. 碳酸氧钠(NaHCO3):工业焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多
3. 碳酸钙(CaCO3):实验室制取CO2,重要的建筑材料,制补钙剂
4. 硫酸铜(CuSO4): 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜
5. 高锰酸钾(KMnO4):常作消毒剂
发现相似题
与“身边处处有化学,它与我们的生活、学习密切相关.请你选用下...”考查相似的试题有:
- 三鹿集团生产的毒奶粉,造成全国几十万幼儿患病和多名死亡.所谓毒奶粉就是在奶粉中添加三聚氰胺(化学式为(NH2CN)3)这种...
- 下列说法不正确的是( )A.用活性炭可以吸附冰箱中的异味B.CO可与人体中的血红蛋白结合,使人因缺氧而窒息C.干冰作致冷剂...
- 在①金刚石、②木炭、③氢气、④碳酸钙、⑤镁、⑥石墨、⑦锌七种物质中,选择适当物质填空:(填序号)(1)自然界存在的最硬物质:_...
- 根据你的经验,你认为下列家庭小实验不能成功的是( )A.用6B铅笔芯做导电性实验B.用食盐水除去菜刀表面的铁锈C.用水、白...
- 区别下列物质的方法中,不能将本组待区别的物质区别开的是( )选项待区别的物质区别方法A木炭粉和铁粉分别在空气中点燃,观...
- 园林工人在树身下部涂上一层石灰浆,石灰浆的作用是 ( )A.美观作用B.杀菌作用C.标记作用D.以上说法都不对
- 请从下列物质中选择适当的物质填空(填字母).A.明矾 B.氧气 C.氢气 D.干冰 E.盐酸 F.肥皂水(1)被称为最理想的“绿色...
- 制取二氧化碳气体时,所得的二氧化碳气体中常会混有少量水蒸气杂质,要除去其中的水蒸气,可将混合气体通入( )A.浓硫酸B.石...
- 下列物质的应用不正确的是( )A.水浇灌庄稼B.不锈钢制餐具C.氧气用于光合作用D.熟石灰改良土壤
- 下列物质敞口放置于空气中,一段时间后质量减少的是A.氧化钙B.浓硫酸C.浓盐酸D.氢氧化钠