本试题 “下列叙述中,不正确的是[ ]A.水通过状态变化,实现自身的天然循环B.在水中氧元素的化合价为-2价C.实验室电解水时,氢原子和氧原子的数目发生了改变D.空气中CO...” 主要考查您对电解水实验
自然界水的循环
化石燃料
化合价的求法
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电解水实验
- 自然界水的循环
- 化石燃料
- 化合价的求法
电解原理
电解就是将两根金属或碳棒(即电极)放在要分解的物质(电解质)中,然后接上电源,使电流通过液体。化合物的阳离子移到带负电的电极(阴极),阴离子移到带正电的电极(阳极),化合物分为二极。
电解过程
用电使化合物分解的过程就叫电解过程。
水(H2O)被电解生成电解水。电流通过水(H2O)时,氢气在阴极形成,氧气则在阳极形成。带正电荷的离子向阴极移动,溶于水中的矿物质钙、镁、钾、钠……带正电荷的离子,便在阴极形成,就是我们所喝的碱性水;而带负电的离子,在阴极生成。
电解水实验:
1.实验装置图:
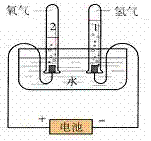
2.表达式:
水 氢气+氧气
氢气+氧气
2H2O 2H2↑+O2↑
2H2↑+O2↑
3.实验现象:
(1)通电后两电极上都有气泡产生;
(2)与电源正极相连接的一端产生的气体比连接负极一端产生的气体少,
接负极一端玻璃管中气体的体积是接正极一端玻璃管内气体体积的2倍。
4.产物检验
(1)正极一端的气体能使带火星的木条复燃,证明气体是氧气。
(2)负极一端的气体能燃烧,并看到微弱的淡蓝色火焰(或听到爆鸣声),
证明气体是氢气。
5.实验结论:
(1)水是由氢元素和氧元素组成的。
(2)1个水分子由2个氢原子和1个氧原子构成。
(3)化学变化中,分子可以再分,原子不可以再分。
6.注意事项:
(1)实验前在水中加入少量的氢氧化钠或者稀硫酸,可增强水的导电性,
加快反应速率。
(2)实验开始时产生的氧气和氢气的体积会小于1:2,是因为氢气难溶于水,
氧气不易溶于水,开始产生的氧气有一部分溶于水,实验时间越长,
其比值越接近1:2。
电解水记忆口诀:
水中通入直流电,正氧负氢会出现;氢二氧一体积比,任何时候都不变。
电解就是将两根金属或碳棒(即电极)放在要分解的物质(电解质)中,然后接上电源,使电流通过液体。化合物的阳离子移到带负电的电极(阴极),阴离子移到带正电的电极(阳极),化合物分为二极。
电解过程
用电使化合物分解的过程就叫电解过程。
水(H2O)被电解生成电解水。电流通过水(H2O)时,氢气在阴极形成,氧气则在阳极形成。带正电荷的离子向阴极移动,溶于水中的矿物质钙、镁、钾、钠……带正电荷的离子,便在阴极形成,就是我们所喝的碱性水;而带负电的离子,在阴极生成。
电解水实验:
1.实验装置图:

2.表达式:
水
 氢气+氧气
氢气+氧气2H2O
 2H2↑+O2↑
2H2↑+O2↑3.实验现象:
(1)通电后两电极上都有气泡产生;
(2)与电源正极相连接的一端产生的气体比连接负极一端产生的气体少,
接负极一端玻璃管中气体的体积是接正极一端玻璃管内气体体积的2倍。
4.产物检验
(1)正极一端的气体能使带火星的木条复燃,证明气体是氧气。
(2)负极一端的气体能燃烧,并看到微弱的淡蓝色火焰(或听到爆鸣声),
证明气体是氢气。
5.实验结论:
(1)水是由氢元素和氧元素组成的。
(2)1个水分子由2个氢原子和1个氧原子构成。
(3)化学变化中,分子可以再分,原子不可以再分。
6.注意事项:
(1)实验前在水中加入少量的氢氧化钠或者稀硫酸,可增强水的导电性,
加快反应速率。
(2)实验开始时产生的氧气和氢气的体积会小于1:2,是因为氢气难溶于水,
氧气不易溶于水,开始产生的氧气有一部分溶于水,实验时间越长,
其比值越接近1:2。
电解水记忆口诀:
水中通入直流电,正氧负氢会出现;氢二氧一体积比,任何时候都不变。
定义:
地球表面各种形式的水体是不断相互转化的,水以气态、液态、固态的形式在陆地、海洋和大气间不断循环的过程就是水循环。形成水循环的内因是水在通常环境条件下气态、液态、固态易于转化的特性,外因是太阳辐射和重力作用,为水循环提供了水的物理状态变化和运动能量。
水的循环示意图:
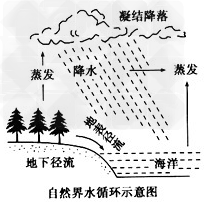
水循环意义:
地球表面各种形式的水体是不断相互转化的,水以气态、液态、固态的形式在陆地、海洋和大气间不断循环的过程就是水循环。形成水循环的内因是水在通常环境条件下气态、液态、固态易于转化的特性,外因是太阳辐射和重力作用,为水循环提供了水的物理状态变化和运动能量。
水的循环示意图:

水循环意义:
| 水循环类型 | 发生空间 | 循环过程及环节 | 特点 | 水循环的意义 |
| 海陆间大循环 | 海洋与陆地之间 | ①蒸发②水汽输送③降水④地表径流⑤下渗⑥地下径流 | 最重要的水循环类型,使陆地水得到补充,水资源得以再生 | ①维持了全球水的动态平衡,使全球各种水体处于不断更新状态 |
| 海上内循环 | 海洋与海洋上空之间 | ①蒸发②降水 | 携带水量最大的水循环,是海陆间大循环的近十倍 | ②使地表个圈层之间,海陆之间实现物质迁移和能量交换 |
| 陆地循环 | 陆地与陆地上空之间 | ①蒸发②植物蒸腾③降水 | 补充陆地水体的少量为数很少 | ③影响全球的气候和生态④塑造者地表形态 |
概念:
化石燃料是由古代动植物的遗骸经过一系列复杂变化而形成的。化石燃料包括煤(工业的粮食),石油(工业的血液)和天然气,是不可再生能源。
煤:
①煤是固体燃料,其最大的缺点是燃烧速率慢,利朋效率低,且不适用于多数运输业作动力源,还会导致严重的大气污染。从资源、经济与环境三方面综合考虑,适宜在煤产地搞热电联产,提高煤炭转换成电能的比重.住城市发展煤气或液化燃料。煤的综合利用煤是我国主要的化石能源,占90%以上,煤的综合利用措施主要有下列三条:
a.煤的气化:目前主要是煤在高温下与水蒸气的反应。产物为燃料气,又可作化工原料。主要产品有CO、CH4、H2等。
b.煤的焦化:也称煤的干馏,是在隔绝空气的条件下加强热.使组成煤的物质发生分解反应。主要产品及用途:焦炭:金属冶炼;煤焦油:重要的化工原料;焦炉气:含有CO、CH4、H2等,既可作燃料又是重要的化工原料。
c. 煤的液化:煤发生化学反应,分裂为小分子,利用催化剂向小分子中加入氯元素.得到与石油产品成分相近的燃料油,是一项人造石油的技术。
②煤气:
a.煤气的形成:煤气作为一种生活燃料,在一些城市被使用.煤气通常情况下是利用煤与水蒸气在高温条件反应生成的:C+H2O CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体
CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体
b.煤气中报警物质的特性:由于煤气的主要成分CO是一种无色、无味的有毒气体,当煤气泄漏时不易察觉,会危害人体健康甚至危及生命。为了安全起见,通常在煤气中加入一些持殊的物质,如乙硫醇(C2H5SH)。乙硫醇具有特殊刺激性气味,当煤气泄漏时,可以使人很快警觉,并马上采取措施,防止发生爆炸、火灾和中毒事故;同时,乙硫醇在煤气燃烧过称中可以充分燃烧不仪煤气.其他可燃性气体如天然气、液化石油气中通常也加入少量报警物质。
石油的综合利用:
①石油是由多种物质组成的混合物,没有同定的组成和性质,根据组成石油的各组分的沸点不同,可从石油中分离出不同的燃料,如汽油、煤油、液化石油气等,
②石油分馏产品及用途
溶剂油——溶剂
汽油—一汽车燃料
航空煤油一一飞机燃料
柴油一—拖拉机、轮船燃料
润滑油一一润滑剂
石蜡——蜡烛
沥青——筑路
石油不仅是优质的能量来源,还是宝贵的化工资源。使石油中的大分子断裂为小分子.小分子重新组合成大分子,从而把石油转化为工农业、医疗、化工等产品,因此把石油称怍“工业的血液”。石油化学工业不同于石油分离,石油化学工业是石油发生复杂的反应,从而生成各种产品,是化学变化。
天然气:
天然气的主要成分是甲烷,主要含碳、氢两种元素。天然气里的甲烷是在隔绝空气的情况下,主要由植物残体分解而生成的。有石油的地方,一般就有天然气。天然气是一种重要的气体燃料。但其贮藏量是有限的。
①甲烷的组成
甲烷是由碳、氢两种元素组成的化合物,其化学式为CH4,是一种最简单的有机物,其中含氢元素的质量分数为25%,是氢元素含量最高的有机物。
②甲烷的性质
a. 物理性质:无色,无味的气体,极难溶于水,它的密度比空气小。
b. 化学性质——可燃性
纯净的甲烷在空气中能安静地燃烧在火焰上方罩一冷而干燥的小烧杯,然后再换一个内壁有石灰水的小烧杯。
现象:烧杯内壁有水珠生成,烧杯内壁的石灰水变浑浊。
结论:甲烷中含有碳元素和氢元素,是由碳和氢两种元素组成的化合物,化学式为CH4。
化学方程式:CH4+O2 CO2+H2O
CO2+H2O
c. 当甲烷与氧气或空气混合后,点燃就有发生爆炸的危险(按体积计算爆炸极限为5%—15%),所以在煤矿的矿井里必须采取通风,严禁烟火等安全措施,以防甲烷和空气等混合发生爆炸。
煤,石油,天然气的区别
化石燃料燃烧与环境的关系:
①化石燃料燃烧产生的物质
化石燃料煤、石油和天然气都是含碳元素的物质.其中还含硫元素等杂质。这些燃料燃烧时,会产生二氧化硫等污染空气的气体,燃料燃烧不充分,会产生一氧化碳和碳粒,加上未燃烧的碳氢化合物,如果直接排放到空气中必然对空气造成污染化石燃料燃烧时排放出的物质有:
a.一氧化碳:
b.碳氢化合物;
c.碳粒和尘粒;
d.二氧化碳
②煤燃烧产生的有害物质
由于煤所含元素有C、H、N、S、O等几种,所以煤燃烧时会排放出二氧化硫、氮的氧化物等.这些气体溶于水会形成酸雨,酸雨会对森林、雕像、建筑物等造成腐蚀。当煤未充分燃烧时,会产生一氧化碳,一氧化碳是夺气的污染物。煤在燃烧时,会散出固体小颗粒(未燃烧的碳粒),造成对空气的粉尘污染。家庭里用煤炉烧煤时,常常会闻到一股激性气味,并看到炉口上方蓝色火焰、这种刺激气昧是烧煤时产生的二氧化硫的气味,蓝色火焰主要是生成的一氧化碳燃烧而产生的。二氧化碳的大量排放,超过自然界的消耗能力,就会引起温室效应,会使大气变暖,陆地减少。
③减少煤燃烧污染的措施
a.燃烧低硫优质煤,或是采用燃料脱硫技术.减少SO2的排放;
b.尽量使燃料完全燃烧;
c.减少化石燃料的使用,开发新能源:
d.植树造林;
e.变分散供热为集中供热。
④汽车用燃料燃烧对空气的影响及减少空气污染的措施
化石燃料的使用与开发:
现有的化石燃料是有限的,而且是不可再生的,每种化石燃料都确有用尽的时候。下表是我同1998年探明的化石燃料储量及产量和使用年限
从表中数据可以看出,节约能源是完全有必要的,也是十分重要的
节约能源,充分利用能源,使燃料充分燃烧,可从以下两个方面着手:
①燃烧时要有足够的空气;
②燃料与空气要有足够大的接触面积,充足的空气才能使燃料尽可能完全燃烧,与空气充分接触才能使其反应快,对能量的利用损失小,
化石燃料是由古代动植物的遗骸经过一系列复杂变化而形成的。化石燃料包括煤(工业的粮食),石油(工业的血液)和天然气,是不可再生能源。
煤:
①煤是固体燃料,其最大的缺点是燃烧速率慢,利朋效率低,且不适用于多数运输业作动力源,还会导致严重的大气污染。从资源、经济与环境三方面综合考虑,适宜在煤产地搞热电联产,提高煤炭转换成电能的比重.住城市发展煤气或液化燃料。煤的综合利用煤是我国主要的化石能源,占90%以上,煤的综合利用措施主要有下列三条:
a.煤的气化:目前主要是煤在高温下与水蒸气的反应。产物为燃料气,又可作化工原料。主要产品有CO、CH4、H2等。
b.煤的焦化:也称煤的干馏,是在隔绝空气的条件下加强热.使组成煤的物质发生分解反应。主要产品及用途:焦炭:金属冶炼;煤焦油:重要的化工原料;焦炉气:含有CO、CH4、H2等,既可作燃料又是重要的化工原料。
c. 煤的液化:煤发生化学反应,分裂为小分子,利用催化剂向小分子中加入氯元素.得到与石油产品成分相近的燃料油,是一项人造石油的技术。
②煤气:
a.煤气的形成:煤气作为一种生活燃料,在一些城市被使用.煤气通常情况下是利用煤与水蒸气在高温条件反应生成的:C+H2O
 CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体
CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体 b.煤气中报警物质的特性:由于煤气的主要成分CO是一种无色、无味的有毒气体,当煤气泄漏时不易察觉,会危害人体健康甚至危及生命。为了安全起见,通常在煤气中加入一些持殊的物质,如乙硫醇(C2H5SH)。乙硫醇具有特殊刺激性气味,当煤气泄漏时,可以使人很快警觉,并马上采取措施,防止发生爆炸、火灾和中毒事故;同时,乙硫醇在煤气燃烧过称中可以充分燃烧不仪煤气.其他可燃性气体如天然气、液化石油气中通常也加入少量报警物质。
石油的综合利用:
①石油是由多种物质组成的混合物,没有同定的组成和性质,根据组成石油的各组分的沸点不同,可从石油中分离出不同的燃料,如汽油、煤油、液化石油气等,
②石油分馏产品及用途
溶剂油——溶剂
汽油—一汽车燃料
航空煤油一一飞机燃料
柴油一—拖拉机、轮船燃料
润滑油一一润滑剂
石蜡——蜡烛
沥青——筑路
石油不仅是优质的能量来源,还是宝贵的化工资源。使石油中的大分子断裂为小分子.小分子重新组合成大分子,从而把石油转化为工农业、医疗、化工等产品,因此把石油称怍“工业的血液”。石油化学工业不同于石油分离,石油化学工业是石油发生复杂的反应,从而生成各种产品,是化学变化。
天然气:
天然气的主要成分是甲烷,主要含碳、氢两种元素。天然气里的甲烷是在隔绝空气的情况下,主要由植物残体分解而生成的。有石油的地方,一般就有天然气。天然气是一种重要的气体燃料。但其贮藏量是有限的。
①甲烷的组成
甲烷是由碳、氢两种元素组成的化合物,其化学式为CH4,是一种最简单的有机物,其中含氢元素的质量分数为25%,是氢元素含量最高的有机物。
②甲烷的性质
a. 物理性质:无色,无味的气体,极难溶于水,它的密度比空气小。
b. 化学性质——可燃性
纯净的甲烷在空气中能安静地燃烧在火焰上方罩一冷而干燥的小烧杯,然后再换一个内壁有石灰水的小烧杯。
现象:烧杯内壁有水珠生成,烧杯内壁的石灰水变浑浊。
结论:甲烷中含有碳元素和氢元素,是由碳和氢两种元素组成的化合物,化学式为CH4。
化学方程式:CH4+O2
 CO2+H2O
CO2+H2Oc. 当甲烷与氧气或空气混合后,点燃就有发生爆炸的危险(按体积计算爆炸极限为5%—15%),所以在煤矿的矿井里必须采取通风,严禁烟火等安全措施,以防甲烷和空气等混合发生爆炸。
煤,石油,天然气的区别
| 煤 | 石油 | 天然气 | |
| 形成 | 古代植物被埋在地下经过一系列复杂变化而形成 | 古代植物遗骸在地壳中经过复杂变化而形成 | |
| 元素组成 | 主要含C;少量含:H、N、S、O等 | 主要含C、H,少量含S、N、O | 主要含C、H,主要成分是CH4 |
| 类别 | 混合物(由有机物和无机物组成) | 混合物(多种有机物) | 混合物 |
| 形态 | 黑色固体,有光泽,人称“黑色金子”,无固定的熔点,沸点,具有可燃性 | 粘稠液体,黑色或棕色,不溶于水,密度比水小,无固定的熔点,沸点 | 无色无味气体,密度比空气小,极难溶于水 |
| 性质 | 煤 焦炭,煤焦油、煤气等 焦炭,煤焦油、煤气等 |
石油 溶剂油,汽油,航空煤油,煤油,柴油等 溶剂油,汽油,航空煤油,煤油,柴油等 |
易燃烧,产生明亮的蓝色火焰,化学方程式为CH4+2O2 CO2+2H2O CO2+2H2O |
化石燃料燃烧与环境的关系:
①化石燃料燃烧产生的物质
化石燃料煤、石油和天然气都是含碳元素的物质.其中还含硫元素等杂质。这些燃料燃烧时,会产生二氧化硫等污染空气的气体,燃料燃烧不充分,会产生一氧化碳和碳粒,加上未燃烧的碳氢化合物,如果直接排放到空气中必然对空气造成污染化石燃料燃烧时排放出的物质有:
a.一氧化碳:
b.碳氢化合物;
c.碳粒和尘粒;
d.二氧化碳
②煤燃烧产生的有害物质
由于煤所含元素有C、H、N、S、O等几种,所以煤燃烧时会排放出二氧化硫、氮的氧化物等.这些气体溶于水会形成酸雨,酸雨会对森林、雕像、建筑物等造成腐蚀。当煤未充分燃烧时,会产生一氧化碳,一氧化碳是夺气的污染物。煤在燃烧时,会散出固体小颗粒(未燃烧的碳粒),造成对空气的粉尘污染。家庭里用煤炉烧煤时,常常会闻到一股激性气味,并看到炉口上方蓝色火焰、这种刺激气昧是烧煤时产生的二氧化硫的气味,蓝色火焰主要是生成的一氧化碳燃烧而产生的。二氧化碳的大量排放,超过自然界的消耗能力,就会引起温室效应,会使大气变暖,陆地减少。
③减少煤燃烧污染的措施
a.燃烧低硫优质煤,或是采用燃料脱硫技术.减少SO2的排放;
b.尽量使燃料完全燃烧;
c.减少化石燃料的使用,开发新能源:
d.植树造林;
e.变分散供热为集中供热。
④汽车用燃料燃烧对空气的影响及减少空气污染的措施
| 燃料燃烧对空气的影响 | 减少空气污染的措施 | |
| 汽车用燃料的燃烧 | 汽车使用的燃料 (汽油或柴油)燃烧产生的尾气中,主要污染物有一氧化碳、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘等 | ①改进发动机的燃烧方式,使汽油或柴油充分燃烧;②使用催化净化装置,使有害气体转化为无害物质;④使用无铅汽油。禁止含铅物喷排放,同时在管理上加入检测尾气的力度等 |
化石燃料的使用与开发:
现有的化石燃料是有限的,而且是不可再生的,每种化石燃料都确有用尽的时候。下表是我同1998年探明的化石燃料储量及产量和使用年限
| 探明储量 | 年产量 | 使用年限 | |
| 石油 | 32.7亿吨 | 1.6亿 | 约20年 |
| 天然气 | 1.37×104亿立方米 | 217亿立方米 | 约63年 |
| 煤 | 1145亿吨 | 12.4亿 | 约92年 |
节约能源,充分利用能源,使燃料充分燃烧,可从以下两个方面着手:
①燃烧时要有足够的空气;
②燃料与空气要有足够大的接触面积,充足的空气才能使燃料尽可能完全燃烧,与空气充分接触才能使其反应快,对能量的利用损失小,
求化合价:
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。在化合物中正、负化合价代数和等于零,这是求化合价的准则。
几种求法:
一、由化学式或根式
1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数
2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数
3.根据正、负电荷数判断元素(或原子团)的化合价。 在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素质量比
1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值
2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量
三、由质量比
(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值
正负代化合价数和为零:
【例1】试确定化合物K2MnO4中Mn元素的化合价。 解析:设化合物中Mn元素化合价为+x价,依化合物中各元素化合价正负代数和为零的原则有2×(+1)+1×(+x)+4×(-2)=0解之得x=6 故K2MnO4中Mn元素化合价为+6价。
电子层结构法
【例2】元素X的原子最外层上有1个电子,元素Y的原子最外层上有6个电子,则X、Y两元素可形成的化合物的化学式为[] A.XYB.X2YC.XY2D.X3Y 解析:本题的关键可以说是首先得确定在形成化合物时,X、Y两元素所表现的化合价。因X最外层上只有1个电子,最高正价为+1价,Y最外层6个电子,离8电子稳定结构尚差2个,故最低负价为-2价,则X、Y所形成化合物分子式为X2Y,应选B。
质量分数法
【例3】某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71%,则它的化合价为[] A.+1B.+2C.+3D.+4 解析:设该元素的氧化物化学式为RxOy 依题意有59x/(59x+16y)*100%=71% 解得x/y=2:3 故化学式为R2O3,R化合价为+3价,选C。
质量守恒定律法
【例4】某金属氧化物与足量的盐酸反应,生成的氯化物与水的分子数之比为2∶3,则该金属的化合价是[] A.+1B.+2C.+3D.+4
解析:设生成的氯化物化学式为RClx,依题意有分子数之比RClx∶H2O=2∶3根据质量守恒定律可知,反应前后各元素的原子种类和数目不变,生成物中H、Cl的原子个数比也应为1:1,故x值为3,则R的化合价为+3价,选C。
相对分子质量法
【例5】某金属元素的氧化物相对分子质量为M,同价态的氯化物相对分子质量为N,则该元素的化合价数值为[]
解析:设该元素化合价为+x价,相对原子质量为MR
(1)如x为奇数时,氧化物化学式为R2Ox,氯化物化学式为RClx,据题意有
2MR+16x=M(1)
MR+35.5x=N(2)
(2)*2-(1)得x的值为x=+(2N-M)/55
(2)x为偶数时,氧化物化学式为Rox/2氯化物化学式为RClx,据题意有 MR+35.5x=N(4) x=+(N-M)/27.5
质量关系法
【例6】相对原子质量为M的金属单质ag与足量的稀硫酸反应,产生bg氢气,则反应中该金属元素的化合价为[]
解析:设金属在反应中化合价为+x价,则金属单质与生成H2有如下关系:
2R~xH2
2M 2x
a b
故应选B。
相关因素讨论法
【例7】某元素M原子最外层电子数少于5,其氧化物化学式为MxOy,氯化物化学式MClz当y∶z=1∶2时,M的化合价可能是[]
A.+1B.+2C.+3D.+4
解析:M的化合价在数值上等于z的值
如y=1z=2(合理) y=2z=4(合理) y=3z=6(与最外层电子数少于5不符) 故应选B、D。
发现相似题
与“下列叙述中,不正确的是[ ]A.水通过状态变化,实现自身的天然...”考查相似的试题有:
- 下述说法中正确的是( )A.水电解生成氢气和氧气,说明水中含有氢分子和氧分子B.在水电解的反应中,氢原子和氧原子都没有发...
- 当电解水的电解器通电一段时间后,你能观察到的现象是A.电极上有气泡产生,两个玻璃内气体的体积之比约为2:1B.水是由氢、氧...
- 根据图所示电解水装置中的现象,判断所接电源的正负极,图中A点表示______极,B点表示______极.实验测得水分解得到氢气、氧...
- 自然界中的水都不是纯水,下列方法能得到纯水的是( )A.吸附B.沉淀C.过滤D.蒸馏
- 下列有关能源的说法正确的是( )A.氢能源没有污染并且成本低,现已普遍使用B.乙醇汽油既节约石油资源,又能促进农业发展C...
- R元素在化合物中只有一种化合价“+3”价,则下列化学方程式中错误的是( )A.2R+3H2SO4=R2(SO4)3+3H2↑B.4R+3O2 点燃 . 2R2O...
- 某种元素的化合价在化学反应前后发生了变化,则该反应为氧化还原反应.据此可判断下列化学反应属于氧化还原反应的是( )A.F...
- 三氧化二碳(C2O3)是金星大气层的成分之一,化学性质与一氧化碳相似.下列有关三氧化二碳的说法中不正确的是( )A.C2O3具...
- 地壳中最多的非金属元素与最多的金属元素结合成的物质的化学式为______.
- (6分)右图是两种化肥标签的一部分,请回答:(1)从标签上看,两种化肥具有共同的物理性质之一是 ;碳酸氢铵不同于尿素的化...