本试题 “(选修3-5选做题)下列关于近代物理中的四种描述,不正确的是[ ]A.在核反应中, X是质子,这个反应过程叫α衰变B.当用蓝色光照射某金属表面时有电子逸出,则...” 主要考查您对光电效应实验规律
玻尔的原子理论
氢原子的能级
核反应
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 光电效应实验规律
- 玻尔的原子理论
- 氢原子的能级
- 核反应
1、在光的照射下物体发射电子的现象叫光电效应。(下图装置中,用弧光灯照射锌版,有电子从锌版表面飞出,使原来不带电的验电器带正电。)

2、光电效应的实验规律

知识扩展:
为什么电子不能一次吸收多个光子而发生光电效应
由于电子非常小,能够捕获光子的几率就非常小,而同时捕获两个光子的几率就更小,有人计算过,一个电子同时捕获两个光子的几率大约为10-34。故可认为一个电子一次只能吸收一个光子。
那么电子为什么不能吸收一个光子后再吸收一个光子从而积累够发生光电效应所需的能量呢?因电子吸收光子的能量后,立即就发生剧烈的热运动,把获得的能量迅速向周围传递开去。到捕获到下一个光子时,原获得的能量早就消耗完了。而在原获得的能量消耗完之前另捕获一个光子,就要求捕获两光子的时间间隔极短。而在极短时间内捕获第二个光子的几率与同时捕获两个光子的几率差别不大(严格说此几率的大小与时间间隔长短有关,时间间隔越长,捕获两个光子的几率就越大,但此时间间隔要求极短)。
玻尔的原子理论:
| 经典理论的困难 | 原子的稳定性 | 电子做加速运动应该辐射电磁波,逐渐减小能量和轨道半径,最终落入原子核,原子是不稳定的,与事实不符 |
| 原子光谱的分立性 | 电子绕核运行辐射频率应等于电子绕核运行频率,由于运行轨道的减小,辐射电磁波频率应不断变化而形成连续光谱,这与原子光谱一明线光谱不符(固定的若干种频率) | |
| 玻尔理论基础 | 实验基础 | 氢原子光谱的分立特征 |
| 理论基础 | 普朗克关于黑体辐射的量子论与爱因斯坦的光子说 | |
| 波尔理论内容 | 量子化假设 | ①电子的轨道是量子化的。电子运行轨道的半径不是任意的,只有半径的大小符合一定条件的轨道才是可能的。电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射 ②原子的能量是量子化的。这些量子化的能量值叫做能级。原子中这些具有确定能量的稳定状态称为定态。能量最低的状态叫做基态,其他的状态叫做激发态 |
| 频率条件 | 当电子从能量较高的定态轨道(Em)跃迁到能量较低的定态轨道(En)时,会放出能量为hv的光子,这个光子的能量由前后两个能级的能量差决定,即hv=Em一En | |
| 对光谱的解释 | 原子光谱的分立性 | 通常情况下,原子处于基态,基态是稳定的,处于激发态的原子是不稳定的。原子从高能态向低能态跃迁时放出的光子的能量等于前后两个能级之差。由于原子的能级是分立的,所以放出的光子的能量也是分立的。因此原子的发射光谱只有一些分立的亮线 |
| 特征谱线 | 由于不同的原子具有不同的结构,能级各不相同,因此辐射(或吸收)的光子频率也不同,这就是不同元素的原子具有不同的特征谱线的原因 | |
| 氢原子光谱线系 | 玻尔理论不但成功地解释了氢光谱的巴耳末系,而且对当时已发现的氢光谱的另一线系——帕邢系(在近红外区)也能很好地解释。它是电子从n=4、5、6等能级向n=3 能级跃迁时辐射出来的。此外,玻尔理论还预言了当时尚未发现的氢原子的其他光谱线系,这些线系后来相继被发现,也都跟玻尔理论的预言相符 |
玻尔的原子理论的成功与局限:
玻尔的原子理论第一次将量子观引入原子领域,提出定态和跃迁的概念,成功地解释了氢原子光谱规律,但玻尔引入的量子化观点并不完善。在量子力学中,核外电子并没有确定的轨道,玻尔的电子轨道只不过是电子出现概率较大的地方。把电子的概率分布用图像表示时,用小黑点的稠密程度代表概率的大小,其结果如同电子在原子核周围形成的云雾,称为“电子云
氢原子的能级:
1、氢原子的能级图 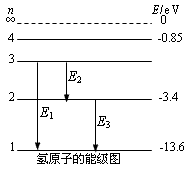
2、光子的发射和吸收
①原子处于基态时最稳定,处于较高能级时会自发地向低能级跃迁,经过一次或几次跃迁到达基态,跃迁时以光子的形式放出能量。
②原子在始末两个能级Em和En(m>n)间跃迁时发射光子的频率为ν,其大小可由下式决定:hυ=Em-En。
③如果原子吸收一定频率的光子,原子得到能量后则从低能级向高能级跃迁。
④原子处于第n能级时,可能观测到的不同波长种类N为:![]() 。
。
⑤原子的能量包括电子的动能和电势能(电势能为电子和原子共有)即:原子的能量En=EKn+EPn。轨道越低,电子的动能越大,但势能更小,原子的能量变小。
电子的动能:![]() ,r越小,EK越大。
,r越小,EK越大。
氢原子的能级及相关物理量:
在氢原子中,电子围绕原子核运动,如将电子的运动看做轨道半径为r的圆周运动,则原子核与电子之间的库仑力提供电子做匀速圆周运动所需的向心力,那么由库仑定律和牛顿第二定律,有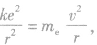 ,则
,则
①电子运动速率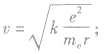
②电子的动能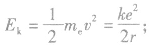
③电子运动周期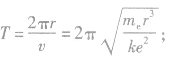
④电子在半径为r的轨道上所具有的电势能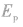
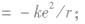
⑤等效电流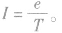 由以上各式可见,电子绕核运动的轨道半径越大,电子的运行速率越小,动能越小,电子运动的周期越大.在各轨道上具有的电视能越大。
由以上各式可见,电子绕核运动的轨道半径越大,电子的运行速率越小,动能越小,电子运动的周期越大.在各轨道上具有的电视能越大。
原子跃迁时光谱线条数的确定方法:
1.直接跃迁与间接跃迁
原子从一种能量状态跃迁到另一种能量状态时,有时可能是直接跃迁,有时可能是间接跃迁,两种情况辐射(或吸收)光子的频率可能不同。
2.一群原子和一个原子
氧原子核外只有一个电子,这个电子在某个时刻只能处在某一个可能的轨道上,在某段时间内,由某一轨道跃迁到另一个轨道时,可能的情况只有一种,但是如果容器中盛有大量的氢原子,这些原子的核外电子跃迁时就会有各种情况出现了。
3.一群氢原子处于量子数为n的激发态时,可能辐射的光谱线条数
如果氢原子处于高能级,对应量子数为n,则就有可能向量子数为(n一1),(n一2),(n一3)…1诸能级跃迁,共可形成(n一1)条谱线,而跃迁至量子数为(n一 1)的氢原子又可向(n一2),(n一3)…1诸能级跃迁,共可形成(n一2)条谱线。同理,还可以形成(n一3),(n 一4)…1条谱线。将以上分析结果归纳求和,则从量子数为n对应的能级向低能级(n—1),(n一2)…1跃迁可形成的谱线总条数为(n一1)+(n一2)+(n一3)+ …+1=n(n一1)/2。数学表示为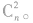
4.一个氢原子处于量子数为n的激发态时,可能辐射的光谱线条数
对于处于量子数为n的一个氢原子,它可能发生直接跃迁,只放出一个光子,也可能先跃迁到某个中间能级上,再跃迁回基态而放出两个光子,也可能逐级跃迁,即先跃迁到n一1能级上,再跃迁到n一2能级上, ……,最后回到基态上,共放出n—1个光子。即一个氢原子在发生能级跃迁时,最少放出一个光子,最多可放出n一1个光子。
利用能量守恒及氢原子能级特征解决跃迁电离等问题的方法:
在原子的跃迁及电离等过程中,总能量仍是守恒的。原子被激发时,原子的始末能级差值等于所吸收的能量,即入射光子的全部能量或者入射粒子的全部或部分能量;原子被电离时,电离能等于原子被电离前所处能级的绝对值,原子所吸收的能量等于原子电离能与电离后电离出的电子的动能之和;辐射时辐射出的光子的能量等于原子的始末能级差。氢原子的能级 F 关系为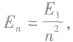 ,第n能级与量子数n2成反比,导致相邻两能级间的能量差不相等,量子数n越大,相邻能级差越小,且第n能级与第n一1能级的差比第n能级与无穷远处的能级差大,即
,第n能级与量子数n2成反比,导致相邻两能级间的能量差不相等,量子数n越大,相邻能级差越小,且第n能级与第n一1能级的差比第n能级与无穷远处的能级差大,即 另外,能级差的大小
另外,能级差的大小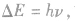 故也可利用光子能量来判定能级差大小。
故也可利用光子能量来判定能级差大小。
跃迁与电离:
激发的方式:
1、定义:原子核在其他粒子的轰击下产生新原子核的过程。所有核反应的反应前后都遵守:质量数守恒、电荷数守恒。
2、原子核的人工转变
①质子的发现:用α粒子轰击氮,
②电子的发现:用α粒子轰击铍,
与“(选修3-5选做题)下列关于近代物理中的四种描述,不正确的是...”考查相似的试题有:
- 用如图所示的光电管研究光电效应的实验中,用某种频率的单色光a照射光电管阴极K,电流计G的指针发生偏转。而用另一频率的单色...
- 一束绿光照射某金属发生了光电效应,则下列正确的是[ ]A.若增加绿光的照射强度,则单位时间内逸出的光电子数目不变B.若增加...
- 用光照射某金属,使它发生光电效应现象,若增加该入射光的强度,则单位时间内从该金属表面逸出的光电子数______,从表面逸出...
- 氢原子从能级m跃迁到能级n时辐射红光的频率为v1,从能级n跃迁到能级k时吸收紫光的频率为v2,已知普朗克常量为h,若氢原子从能...
- 下列说法正确的是( ) A.放射性元素的原子核内的核子有半数发生变化所需的时间就是半衰期 B.光导纤维内芯的折射率比外套小...
- 如图所示为氢原子的能级示意图,一群氢原子处于n=3的激发态,在向较低能级跃迁的过程中向外发出光子,这群氢原子能发出______...
- 【选修3-5选做题】假定用光子能量为E的一束光照射大量处于n=3能级的氢原子,氢原子吸收光子后,能且只能发出频率为ν1、ν2、ν3...
- 多选下列说法正确的是( )A.经一次α衰变后成为B.核由两个中子和两个质子组成C.温度升高不能改变放射性元素的半衰期D.核...
- 1919年,卢瑟福用α粒子轰击氮核发现质子.科学研究表明其核反应过程是:α粒子轰击静止的氮核后形成了不稳定的复核,复核发生...
- (选修模块3-5)(12分)(1)下列说法中正确的是 ▲ A.康普顿效应进一步证实了光的波动特性B.为了解释黑体辐射规律,普朗克提出...