本试题 “对于弱酸,在一定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系.若25℃时有HAH++A-,则K=式中:K为电离平衡常数,只与温度有关,c为各粒子的平...” 主要考查您对电离平衡常数
弱电解质电离的影响因素
强酸和弱酸的比较
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电离平衡常数
- 弱电解质电离的影响因素
- 强酸和弱酸的比较
电离平衡常数:
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用 表示,碱用
表示,碱用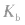 表示)。
表示)。
2.表示方法: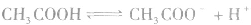
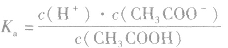
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用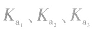 ,等分别表示,且
,等分别表示,且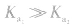
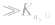
例如: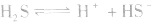
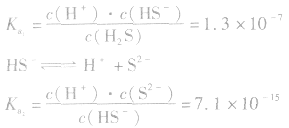
3.影响因素:温度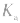 (或
(或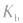 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下, 越大(多元弱酸以
越大(多元弱酸以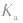 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
1.概念在一定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,简称电离常数。用K表示(酸用
 表示,碱用
表示,碱用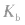 表示)。
表示)。 2.表示方法:
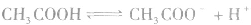
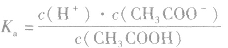
对于多元弱酸,其电离是分步进行的,每步各有电离常数,通常用
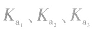 ,等分别表示,且
,等分别表示,且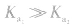
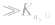
例如:
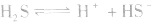
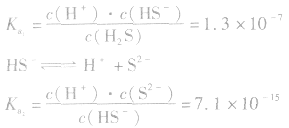
3.影响因素:温度
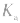 (或
(或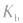 )只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.
)只随温度变化而变化,不随浓度变化而变化。电离平衡常数,类似于化学平衡常数.4.意义:反映弱酸,弱碱酸碱性的相对强弱在一定温度下,
 越大(多元弱酸以
越大(多元弱酸以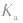 为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。
为依据),弱酸的电离程度就越大,浓度相同时c(H+)也越大,弱酸的酸性越强。电离平衡的影响因素:
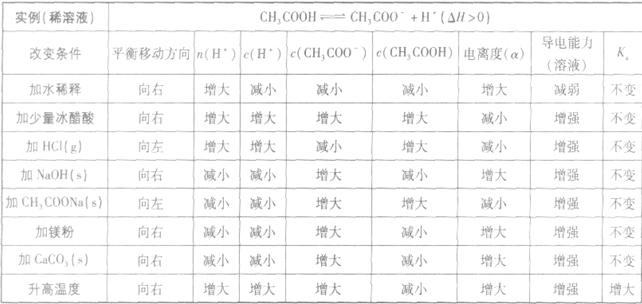
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:

强酸与弱酸(或强碱与弱碱)的比较:
1.强酸与弱酸(或强碱与弱碱)由于电离程度的不同,在很多方面表现出不同的性质 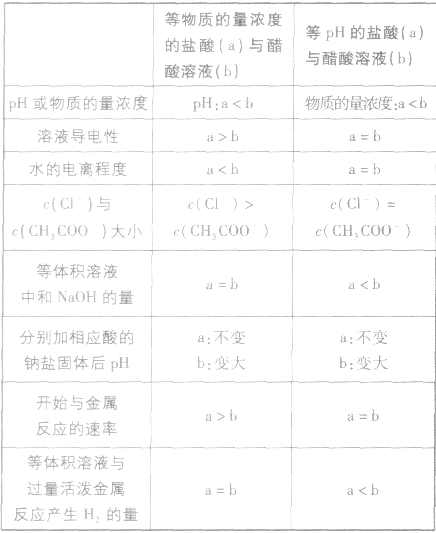
2.稀释时pH变化特点比较如下图:a、b分别为体积相等、pH相等的NaOH溶液和氨水的稀释曲线线;c、d分别为体积相等、pH相等的盐酸和醋酸溶液的稀释曲线,请体会图中的两层含义: 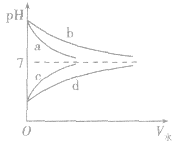
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸溶液。若稀释10n倍,盐酸、Na0H溶液pH变化n个单位,而氨水与醋酸溶液pH变化小到 n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水 >NaOH溶液,醋酸溶液>盐酸。
发现相似题
与“对于弱酸,在一定温度下达到电离平衡时,各粒子的浓度存在一...”考查相似的试题有:
- 下列溶液中,加入少量括号内试剂,在温度不变时,溶液pH减小的是[ ]A.0.1mol/L氨水(AgOH固体)B.饱和NaOH溶液(Na2O2)C...
- 根据要求填空:(1)在0.1mol/L的CH3COOH溶液中,若加入少量的蒸馏水,溶液的pH ;若加入少量的纯醋酸,溶液中的c(CH3COO—) ...
- 下列事实中,能说明MOH是弱碱的有①0.1mol/LMOH可以使酚酞试液变红②0.1mol/LMCl溶液的呈酸性③0.1mol/LMOH溶液的导电性比0....
- 常温下,将0.1 mo1·L一1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是A.CH3COOH的电离平衡常数增大为原来的10...
- 下列电离方程式中,书写正确的是 ( )A.Cu(OH)2=Cu2++ 2 OH-B.NH3·H2ONH4++ OH-C.HF= H++ F-D.H3PO43 H++ PO43-
- 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。该同学设计了如下...
- (12分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(1)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的...
- 25℃ 时,水的离子积为Kw,该温度下将 a mol ·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全反应,下列结论...
- 用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶...
- 向甲烧杯中加入盐酸,乙烧杯中加入醋酸,两种溶液的体积和pH 都相等。再向两烧杯中同时加入质量不等的锌粒,反应结束后得到等...