本试题 “(2010•福建)下列关于电解质溶液的正确判断是( )A.在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以常量共存B.在pH=0的溶液中,Na+、NO3-、SO32-、K+可以常量...” 主要考查您对离子共存
弱电解质的电离
盐类水解判断溶液酸碱性或比较溶液pH值的大小
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子共存
- 弱电解质的电离
- 盐类水解判断溶液酸碱性或比较溶液pH值的大小
离子共存:
所谓离子共存实质上就是看离子间是否发生反应。若离子在溶液中发生反应,就不能共存。
判断离子是否共存的几种情况:
(1)发生复分解反应,离子不能大量共存。
①有气体产生 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成 如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成 如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存
①具有较强还原性的离子不能与具有较强氧化性的离子大量共存 如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存 如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O不能共存 ;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
(2)溶液的颜色:有色离子MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)、Fe(SCN)2+(红)、Fe(SCN)63-(血红)。
(3)要求“大量共存”还是“不能大量共存”。
所谓离子共存实质上就是看离子间是否发生反应。若离子在溶液中发生反应,就不能共存。
因能发生氧化还原反应而不共存的离子有:
(注:“√”表示能发生反应,“×”表示不能发生反应)
|
|
S2- |
SO32- |
I- |
Fe2+ |
Br- |
Cl-(H+) |
|
MnO4- |
√ |
√ |
√ |
√ |
√ |
√ |
|
ClO- |
√ |
√ |
√ |
√ |
√ |
√ |
|
NO3-(H+) |
√ |
√ |
√ |
√ |
√ |
× |
|
Fe3+ |
√ |
√ |
√ |
× |
× |
× |
因能发生复分解反应而不共存的离子有:
- 离子间相互结合生成难溶物或微溶物
Ba2+、Ca2+ CO32-、SO32-、SO42- Ag+ CO32-、SO32-、Cl- - 离子间相互结合生成气体或挥发性物质
H+ CO32-、HCO3-、SO32-、HSO3-、S2-、HS- OH- NH4+ - 离子间相互结合生成弱电解质
H+ CO32-、SO32-、S2-、CH3COO-、F- 弱酸 OH- NH4+、Al3+、Fe3+、Cu2+、Mg2+ 弱碱 H+ 水
因能发生双水解的离子有:
| Al3+ | CO32-、HCO3-、SO32-、HSO3-、S2-、HS-、AlO2-、ClO- |
| Fe3+ | CO32-、HCO3-、AlO2-、ClO- |
| NH4+ | SiO32-、AlO2- |
因发生络合反应而不共存的离子有:
| Fe3+ | SCN- |
| Ag+、Cu2+ | NH3·H2O |
判断离子是否共存的几种情况:
(1)发生复分解反应,离子不能大量共存。
①有气体产生 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成 如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成 如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存
①具有较强还原性的离子不能与具有较强氧化性的离子大量共存 如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存 如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O不能共存 ;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
(2)溶液的颜色:有色离子MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)、Fe(SCN)2+(红)、Fe(SCN)63-(血红)。
(3)要求“大量共存”还是“不能大量共存”。
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
盐类水解原理的应用:
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
酸式盐溶液酸碱性的判断:
酸式盐的水溶液显什么性,要看该盐的组成微粒。
1.强酸的酸式盐只电离,不水解,溶液一定显酸性。如 溶液:
溶液: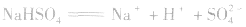
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液显碱性。例如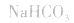 溶液中:
溶液中: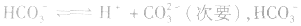
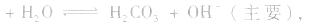
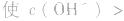
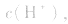 溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
(2)若电离程度大于水解程度,溶液显酸性。例如 溶液中:
溶液中: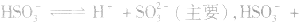
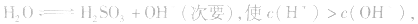 溶液显酸性
溶液显酸性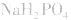 溶液亦显酸性。
溶液亦显酸性。
盐溶液蒸干后所得物质的判断:
1.考虑盐是否分解。如加热蒸干 溶液,因
溶液,因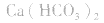 分解,所得固体应是
分解,所得固体应是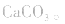
2.考虑氧化还原反应。如加热蒸干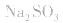 溶液,因
溶液,因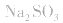 易被氧化,所得固体应是
易被氧化,所得固体应是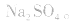
3.盐水解生成挥发性酸时,蒸干后一般得到弱碱,如蒸干 溶液,得
溶液,得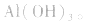 盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干
盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干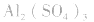 溶液,得
溶液,得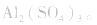
4.盐水解生成强碱时,蒸干后一般得到原物质,如蒸干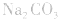 溶液,得到
溶液,得到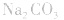 等。
等。
5.有时要多方面考虑,如加热蒸干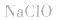 溶液时,既要考虑水解,又要考虑
溶液时,既要考虑水解,又要考虑 的分解,所得固体为
的分解,所得固体为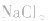
发现相似题
与“(2010•福建)下列关于电解质溶液的正确判断是( )A.在pH=1...”考查相似的试题有:
- 常温下,下列各组离子在指定溶液中能大量共存的是( )A.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO 3-、Cl-B.pH=1的...
- 在水溶液中能大量共存的一组是( )A.Fe2+、Al3+、ClO-、Cl-B.K+、Cu2+、OH-、NO-3C.Mg2+ H+ SiO2-3 SO2-4D.NH+4 Na+ Br-...
- 下列各组离子反应中,可用H++ OH-=H2O表示的是A.氢氧化钡和硫酸B.氢氧化铁和盐酸C.醋酸和氢氧化钠D.硫酸氢钠和氢氧化钾
- 在pH=1的无色溶液中,下列离子能大量共存的是[ ]A.NH4+.Ba2+.NO3-.CO32-B.Fe2+.OH-.SO42-.MnO4-C.K+.Mg2+.NO3-.S...
- 常温下,下列各组离子在指定溶液中能大量共存的是[ ]A.pH=1的无色溶液:Na+、Cu2+、NO3-、SO42-B.c(H+)=1.0×10-13mol·...
- 甲酸的下列性质中可以证明它是弱电解质的是[ ]A.1 mol·L-1的甲酸溶液的c(H+)约为0.01 mol·L-1B.甲酸与活泼金属反应生...
- 某化学兴趣小组的同学通过实验比较等体积(200mL)0.55mol/L硫酸、1.1mol/L盐酸、1.1mol/L醋酸分别与过量金属反应生成氢气的...
- 常温下甲为pH=2的醋酸溶液;乙为pH=2的醋酸和盐酸的混合液,等体积的甲乙两溶液相比,下列说法正确的是( )A.乙溶液中c(OH...
- 温度一定时,用水稀释0.1mol/L氨水时,溶液中随着加水量的增加而减小的是( )A.c(OH-)B.c(OH-)/c(NH3•H2O)C.c(H+...
- 下列关于电解质溶液的正确判断是[ ]A.在pH = 12的溶液中,K+、Cl-、HCO3-、Na+可以常量共存B.在pH=0的溶液中,Na+、NO3-、...