本试题 “在乙烯分子中有5个σ键、一个π键,它们分别是[ ]A. sp2杂化轨道形成σ键、未杂化的2p轨道形成π键B. sp2杂化轨道形成π键、未杂化的2p轨道形成σ键C. C-H之间是sp2...” 主要考查您对杂化轨道理论(中心原子杂化方式)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 杂化轨道理论(中心原子杂化方式)
杂化轨道理论:
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
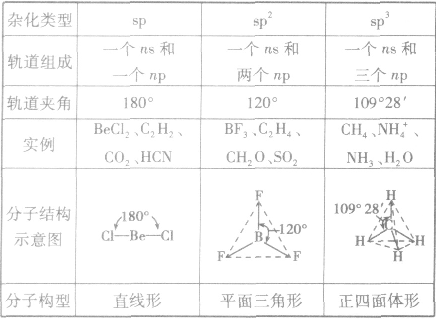
发现相似题
与“在乙烯分子中有5个σ键、一个π键,它们分别是[ ]A. sp2杂化轨...”考查相似的试题有:
- 下列关于杂化轨道的叙述中,不正确的是[ ]A.分子中中心原子通过SP3杂化轨道成键时,该分子不一定为正四面体结构B.杂化轨道...
- 已知A、J、D、E、G是元素周期表中1~36号元素,其原子序数依次增大。A与另外四种元素既不在同一周期,也不在同一主族。J和D同...
- 雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。(1)元素第一电离能:Al________Mg(选填:“...
- 硫酸铜晶体溶解后溶液呈天蓝色,再滴加氨水,首先生成沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液,再加入无水乙醇,...
- 下列有关分子中的化学键描述不正确的是[ ]A.苯分子中每个碳原子的sp2杂化轨道形成σ键,未参加杂化的2p轨道形成大π键B.乙炔...
- (三选一)【选修3:物质结构与性质】硅与金刚砂(SiC)是两种重要的工业产品,它们都可由二氧化硅与碳反应制得。(1)由SiO2...
- A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数只有一个,B原子2p能级有...
- 原于轨道的杂化不但出现在分子中,原子团中同样也存在原子轨道的杂化,在SO42-中S原子的杂化方式为[ ]A.spB.sp2C.sp3D.无法判断
- A.乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表...
- 常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答(1)“氯盐类”融雪剂主要成分的晶体类型为______;(2)...