本试题 “分别向下列溶液中加入少量的过氧化钠固体,不会出现浑浊的是[ ]A.Na2CO3溶液B.FeCl3溶液C.饱和Ca(OH)2溶液D.CuSO4溶液” 主要考查您对过氧化钠
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 过氧化钠
过氧化钠(Na2O2)的基本性质:
淡黄色固体,较稳定,可用作供氧剂、漂白剂
(1)与水反应:2Na2O2+2H2O==4NaOH+O2↑
(2)与CO2反应:2Na2O2+2CO2==2Na2CO3+ O2
(3)与HCl反应:2Na2O2+4HCl==4NaCl+2H2O+ O2↑
过氧化钠的特性及计算:
1.过氧化钠的强氧化性
2.Na2O2与CO2、H2O(g)反应的重要关系
(1)气体体积差的关系
2Na2O2+2CO2===2Na2CO3+O2 气体体积差 ①
2 1 ΔV=1
2Na2O2+2H2O(g)===4NaOH+O2 气体体积差 ②
2 1 ΔV=1
由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的1/2,即为生成氧气的量。
(2)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,剩余的Na2O2再与H2O(g)反应。
(3)电子转移关系
当Na2O2与CO2或H2O反应时,每产生1molO2就转移2mol电子。
(4)固体质量变化关系
①足量过氧化钠与水、CO2反应的计算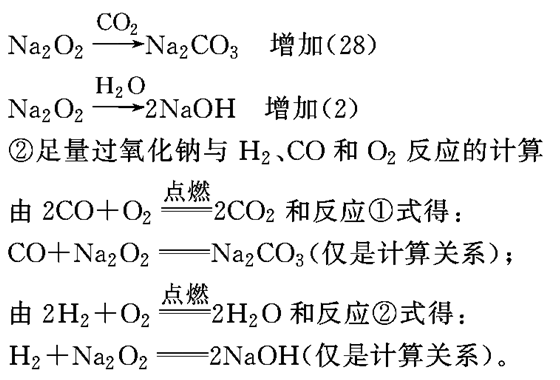
所以,有ag通式符合(CO)m(H2)n(m=0,1,2,3…,n=0,1,2,3…)的物质(包括纯净物和混合物)在氧气中燃烧,将其通过足量过氧化钠,反应完毕后,固体增重ag。
氧化钠与过氧化钠的比较:
| 物质 | 氧化钠 | 过氧化钠 |
| 色态 | 白色固体 | 淡黄色固体 |
| 类别 | 碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 | 仅含离子键 | 离子键和非极性键 |
| 电子式 | 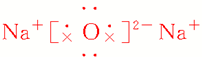 |
 |
| 生成条件 | 常温 | 点燃或加热 |
| 氧的化合价 | -2 | -1 |
| 阴阳离子个数比 | 1:2 | 1:2 |
| 稳定性 | 不稳定 | 稳定 |
| 转化关系 | 2Na2O+O2=2Na2O2 | |
| 用途 | 用于制取少量过氧化钠 | 供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 | 2Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 | Na2O+CO2=NaCO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 | 隔绝空气、密封保存 | 隔绝空气、远离易燃物、密封保存 |
特别提醒:
(1)用脱脂棉包裹住过氧化钠,滴加少量水时脱脂棉可以燃烧,不仅可以说明Na2O2与H2O反应生成O2,还可以说明该反应放热。
(2)Na2O2与H2O反应时H2O既不是氧化剂也不是还原剂。
方法技巧:Na2O与Na2O2的结构与性质
(1)Na2O中只含离子键,Na2O2中既含离子键,又含非极性键。
(2)等物质的量的Na2O与Na2O2分别于等量且足量的H2O反应,所得溶液的成分浓度相同
与“分别向下列溶液中加入少量的过氧化钠固体,不会出现浑浊的是[...”考查相似的试题有:
- 把一小粒金属钠放入足量的硫酸铜溶液中。下列物质中属于该反应最终产物的是( )A.CuB.NaOHC.CuOD.Cu(OH)2
- (6分)完成下列各小题中的化学反应方程式。⑴碱金属与O2反应生成氧化物较复杂,有普通氧化物(如Na2O)过氧化物(如Na2O2)还...
- 将一小块钠放在石棉网上加热,下列组合正确的是( )①燃烧,黄色火星四射②金属熔化③燃烧火焰为黄色④燃烧生成白色固体⑤燃烧生成...
- (6分)某天然碱可以看作是CO2和NaOH反应后的产物组成的一种物质。为了测定该物质的成分,进行如下实验:⑴称取3.32g天然碱样...
- A、B、C、D、E五种物质之间有下图所示的转化关系。已知:A是第三周期的金属单质,其焰色反应呈黄色;C、E是非金属气体单质,...
- 将NaHCO3置于干的试管中加热,并使放出的气体依次通过盛有足量过氧化钠和碱石灰的干燥管,最后得到的气体有( )A.CO2、、H2...
- (1)用金属钠制取过氧化钠的化学方程式是 ____,现象是____。(2)已知用金属钠生成氧化钠,可有多种方法:①4Na+ O2=2Na2O;②4Na+...
- (8分)石棉是一类建筑材料,主要成分为硅酸盐,有毒,化学式是Na2Fe5Si8O22(OH)2。(1)该石棉中与5个铁原子形成氧化物的...
- (5分)一块表面已部分氧化(氧化层为Na2O)的金属钠样品质量为0.77g,放入100mL水中后,得到标准状况下氢气的体积224mL,求:(1)...
- 跟Na、Na2O、Na2O2、NaOH、Na2CO3、NaHCO3六种物质都能发生反应的是( )A.H2OB.CO2C.Ca(OH)2D.H2SO4