本试题 “根据热化学方程式:S(l)+O2(g)=SO2(g) ΔH=-293.23 kJ/mol,分析下列说法正确的是[ ]A.S(s)+O2(g)=SO2(g),反应放出的热量大于293.23 kJ/molB.S(g)+...” 主要考查您对化学键与化学反应中能量变化的关系
焓变、反应热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学键与化学反应中能量变化的关系
- 焓变、反应热
化学键与化学反应中能量变化的关系:
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。
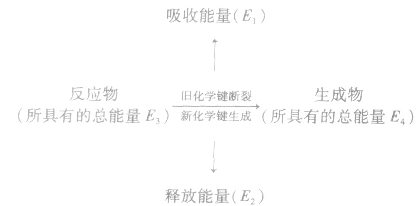
若 反应为放热反应;若
反应为放热反应;若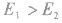 或
或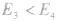 ,反应为吸热反应。
,反应为吸热反应。
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若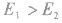 或
或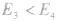 ,反应为吸热反应。
,反应为吸热反应。反应热,焓变:
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
发现相似题
与“根据热化学方程式:S(l)+O2(g)=SO2(g) ΔH=-293.23 kJ/mo...”考查相似的试题有:
- 按要求完成下列原电池电极反应式或总反应的化学方程式。(1)我国发射的“神舟”六号载人飞船是采用先进的甲烷电池为电能的,该...
- 下列叙述中正确的是A.NH3、CO、CO2都是极性分子B.CH4、CCl4都是含有极性键的非极性分子C.NaCl和CsCl晶体中阳离子的配位数...
- 下列含有共价键的离子化合物是( )A.NH4ClB.H2OC.N2D.MgCl2
- 在36 g碳不完全燃烧所得气体中,CO占体积,CO2占体积。且有:C(s)+O2(g)CO(g) ΔH="-110.5" kJ·mol-1CO(g)+O2(g)CO2(g) ΔH="-28...
- (10分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池...
- 下列热化学方程式中,正确的是( )A.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=...
- 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH37N2...
- 关于化学反应与能量的说法正确的是( )A.中和反应是吸热反应B.燃烧属于吸热反应C.反应物总能量与生成物总能量一定相等D....
- SF6是一种优良的气体绝缘材料,分子结构中只存在S—F键。发生反应的热化学方程式为:S(s)+ 3F2(g) = SF6(g) ΔH=" -1220" kJ/...
- 已知在一定条件下,CO的燃烧热为283 kJ/mol,CH4的燃烧热为890 kJ/mol,由1 mol CO和3 mol CH4组成混合气体在上述条件下充分...