本试题 “下列叙述中正确的是[ ]A.干冰汽化时化学键发生断裂B.SiO2晶体有多种晶型,其基本结构单元是[SiO4]四面体结构C.Na2O和Na2O2所含化学键类型完全相同D.Br2蒸...” 主要考查您对原子晶体
共价键
离子键
范德华力
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子晶体
- 共价键
- 离子键
- 范德华力
相邻原子间以共价键相结合而形成空间网状结构的晶体,熔沸点高,导热性、延展性不良,导电性差,硬度大。如:金刚石、石英。
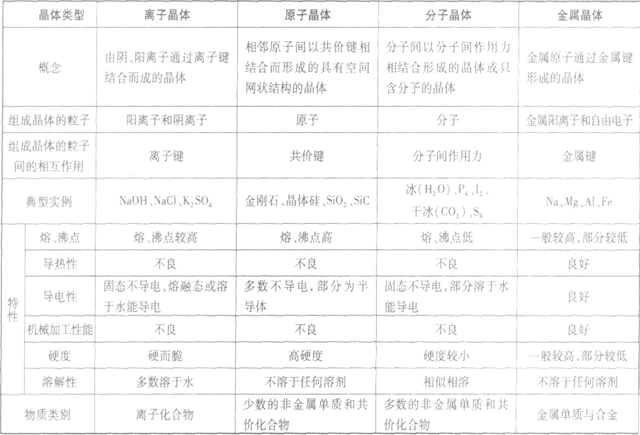
晶体的基本类型与性质:
晶体熔、沸点高低的比较规律:
(1)不同类型晶体的熔、沸点高低规律:一般,原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高,如钨、铂等;有的则很低,如汞、铯等。
(2)同种类型晶体,晶体内粒子间的作用力越大,熔、沸点越高。
①分子晶体:分子间作用力越大,物质的熔、沸点越高,反之越低。
a.组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。如沸点:O2>N2、HI>HBI>HCl(含氢键的除外)。
b.相对分子质量相等或相近的分子,极性分子的范德华力大,熔、沸点高。如沸点:CO>N2。
c.含有氢键的分子熔、沸点比较高。如沸点:H2O >H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
d.在烷烃的同分异构体中,一般来说,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物苯环上的同分异构体熔、沸点大小一般按照“邻位>问位>对位”的顺序。
e.在高级脂肪酸形成的油脂中,油的熔、沸点比脂肪低,烃基部分的不饱和程度越大(碳碳双键越多),熔、沸点越低,如:
(C17H35COO)3C3H5>(C17H33COO)3C3H5
硬脂酸甘油酯 油酸甘油酯
②原子晶体:要比较共价键的强弱。一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如熔点:金刚石(C—C)>金刚砂 (Si—C)>晶体硅(Si—Si)>锗(Ge—Ge)。
③离子晶体:要比较离子键的强弱。一般来说,阴、阳离子电荷数越多,离子半径越小,离子键越强,熔、沸点越高,如熔点:MgO>NaCl,KF>KCl>KBr> KI。离子晶体的晶格能越大,其熔、沸点越高。
④金属晶体:要比较金属键的强弱。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子间的静电作用越强,金属键越强,熔、沸点越高,反之越低,如熔点:Na<Mg<Al。
(3)元素周期表中ⅦA族卤素的单质(分子晶体) 的熔、沸点随原子序数递增而升高;笫IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。如熔、沸点:Li>Na>K>Rb>Cs。
注意:上述总结的是一般规律,不能绝对化。在具体比较晶体的熔、沸点高低时,应先弄清晶体的类型,然后根据不同类型晶体进行判断,但应注意具体问题具体分析。如MgO为离子晶体,[大]为离子半径小且离子电荷多,离子键较强,其熔点(2852℃)要高于部分原子晶体,如SiO2(1710℃)。
共价键:
1.本质原子之间形成共用电子对(或电子云重叠),使得电子出现在核间的概率增大。
2.特征
具有方向性与饱和性。
(1)共价键的饱和性一个原子中的一个未成对电子与另一个原子中的一个未成对电子配对成键后,一般来说就不能再与其他原子的未成对电子配对成键了,即每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,这称为共价键的饱和性。
例如,氯原子中只有一个未成对电子,所以两个氯原子之间可以形成一个共价键,结合成氯分子,表示为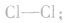 氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为
氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为 一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为
一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为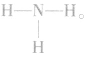
(2)共价键的方向性
共价键将尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。除s轨道是球形对称外,其他原子轨道都具有一定的空间分布。在形成共价键时,原子轨道重叠得越多,电子在核间出现的概率越大,所形成的共价键就越牢固。
例如,硫原子的价电子排布是 有两个未成对电子,如果它们分布在互相垂直的
有两个未成对电子,如果它们分布在互相垂直的 轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的
轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的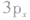 轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的
轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的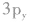 轨道上的电子配对成键。
轨道上的电子配对成键。
说明:
①共价键的饱和性决定着各种原子形成分子时相互结合的数量关系。如一个氢分子只能由两个氢原子构成,一个水分子只能由两个氢原子和一个氧原子构成。
②共价键的方向性决定着分子的空间构型。
3.分类
(1)按成键原子是否相同或共用电子对是否偏移分 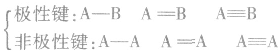
(2)按成键方式分

(3)按共用电子对数分
离子键和共价键:
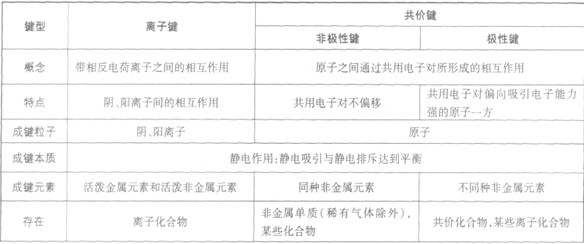

定义:
使阴阳离子结合成化合物的静电作用叫离子键。
成键元素:
活泼金属(或NH4+)与活泼的非金属或酸根离子、OH-
静电作用:
指静电吸引和静电排斥的作用
范德华力:
(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ/mol,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。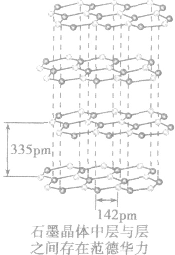
水分子间氢键的表示方法及意义:
(1)表示方法:如下图所示

(2)意义:水分子问存在氢键,使水的熔点和沸点升高,高于同主族其他元素的气态氢化物,所以常温常压下水呈液态。另外,在同态水(冰晶体)中,水分子间以氢键结合成排列规整的晶体,水分子间的氢键使冰的结构里存在较大的空隙,造成体积膨胀、密度减小至低于液态水的密度。水的这种性质对水生动物的生存有重要意义。
范德华力和氢键:
| 范德华力 | 氢键 | |
| 概念 | 把分子聚集在一起的作用力 | 分子中与氢原子形成共价键的非金属元素原子如果吸引电子的能力很强,原子半径很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷,这样的分子之间氢核与带部分负电荷的非金属元素原子相互吸引,这种静电作用就是氢键 |
| 存在范围 | 分子之间 | 某些含强极性键的氢化物分子间(如 HF、H2O、NH3)等 |
| 强弱比较 | 比化学键弱得多 | 比化学键弱,但比范德华力强 |
| 影响因素 | 组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大 | 形成氢键的除H外的非金属元素原子吸引电子的能力越强,半径越小,则氢键越强 |
| 对物质性质的影响 | 影响物质的熔沸点、溶解度等物理性质。一般来说,组成和结构相似的由分子组成的物质,随相对分子质量的增大,物质的熔沸点升高,如熔沸点: 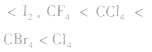 |
分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O 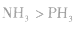 |
与“下列叙述中正确的是[ ]A.干冰汽化时化学键发生断裂B.SiO2晶...”考查相似的试题有:
- [化学—选修物质结构与性质](15分)第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念。(1)Pt与Ni在周...
- 碳化硅的晶体有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。它与晶体硅和金刚石相比较,正确的是( )。A.熔点从...
- 下列物质属于分子晶体的是( ) A.熔点是1070℃,易溶于水,水溶液能导电B.熔点是10.31℃,液态不导电,水溶液能导电C.能溶...
- 纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某纳米颗粒分子中粒子分布类似于硼镁化合物,...
- 有关晶体的结构如图所示,下列说法中不正确的是( )。A.在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体B.该气态团簇分子...
- 下列物质中,只含有共价键的化合物是( )A.金刚石B.纯碱C.烧碱D.干冰
- 现有如下各说法①在水中氢.氧原子间均以化学键相结合。②金属和非金属化合形成离子键。③离子键是阳离子.阴离子的相互吸引。④...
- 下列物质中,属于共价化合物的是( )A.Cl2B.NH4ClC.CH4D.KOH
- 下列过程中,共价键被破坏的是[ ]A.碘升华B.溴蒸气被木炭吸附C.酒精溶于水D.HCl气体溶于水
- 下列物质中,存在离子键的是( )A.二氧化硅B.碘单质固体C.干冰D.氯化钠固体