本试题 “计算题:在密闭容器中进行的如下反应:2SO2(g)+O2(g)⇌2SO3(g).SO2的起始浓度是0.4mol/l,O2的起始浓度是1mol/l,当SO2的转化率为50%时,反应达到平衡...” 主要考查您对化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学平衡的有关计算
化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
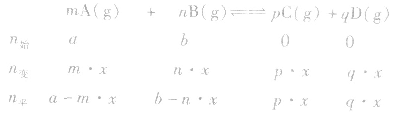
则有:

(2)对于反应物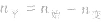 ,对于生成物
,对于生成物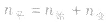
(3)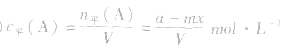
(4)A的转化率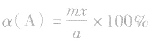
(5)平衡时A的体积(物质的量)分数
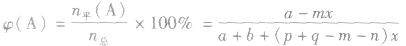
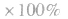
(6)
(7)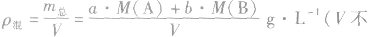
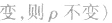
(8)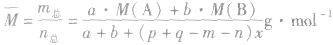
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
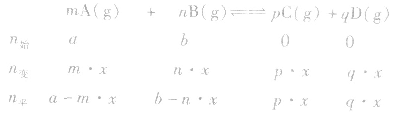
则有:

(2)对于反应物
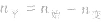 ,对于生成物
,对于生成物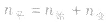
(3)
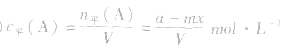
(4)A的转化率
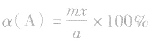
(5)平衡时A的体积(物质的量)分数
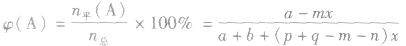
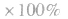
(6)

(7)
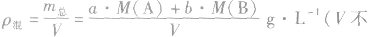
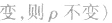
(8)
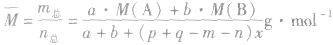
发现相似题
与“计算题:在密闭容器中进行的如下反应:2SO2(g)+O2(g)⇌2SO...”考查相似的试题有:
- 在一定体积的密闭容器中,进行如下化学反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),其化学平衡常数K和温度t的关系如下表:t℃100...
- 压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与NH3含量的一些实验数据:压强/MPa10203060100NH3含量(体积分数...
- 在一定条件下,体积不变的密闭容器中,反应H2(g)+I2(g)2HI(g)一定处于化学平衡状态的是 A.单位时间内有1mol H2消耗,同时...
- 对于反应2SO2+O22SO3下列判断正确的是A.2 mol SO2和足量的O2反应,必生成2 mol SO3B.平衡时SO2、O2、SO3的分子数之比为2∶1∶...
- (8分)氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用。(1)右图是1mol NO2(g)和1mol...
- 一定温度下,在密闭容器中可逆反应.N2(g)+3H2(g)2NH3(g)达到平衡状态,此时N2的转化率为20%,H2的转化率为50%,则平衡...
- 在一密闭容器中充入2 mol A和1 mol B发生如下反应:2A(g)+B(g)xC(g)。该反应达到平衡后,C的体积分数为W%。若维持容器的容积...
- 已知298K时,2SO2(g)+O2(g)2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达...
- 下列有关反应限度的叙述正确的是A.大多数化学反应在一定条件下都有一定的限度B.当可逆反应达到反应限度时,反应会自动停止C...
- 在一定条件下,对于密闭容器中进行的反应:P(g) + Q(g)R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是A....