本试题 “现有以下物质:①铝 ②稀硝酸 ③氯化氢 ④氨气 ⑤甲烷 ⑥氢氧化钠 ⑦氯化钙 ⑧碳酸钡 ⑨氢氧化铜 ⑩水 [(1)—(4)用相应物质的序号填写](1)可以导电的有___________...” 主要考查您对电离方程式
强电解质、弱电解质
电解质、非电解质
导电性(单质、溶液、熔融状态导电)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电离方程式
- 强电解质、弱电解质
- 电解质、非电解质
- 导电性(单质、溶液、熔融状态导电)
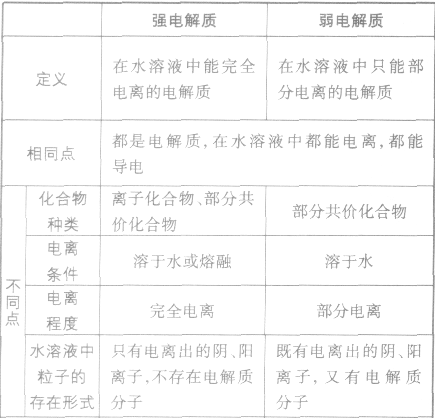
定义:
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“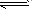 ” 。
” 。
.
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“
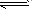 ” 。
” 。.
电离方程式的书写:
1.强电解质的电离用“ ”,弱电解质的电离用 “
”,弱电解质的电离用 “ ”。
”。
2.多元弱酸分步电离,分步持写电离方程式,一般只写第一步;多元弱碱也是分步电离的,但可按一步完全电离写出。例如:
氧硫酸: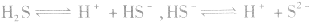
氢氧化铁:
3.强酸的酸式盐完全电离,弱酸的酸式盐中酸式酸根不完全电离。例如: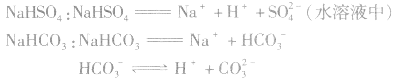
说明:在熔融状态时,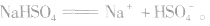
4.某些复盐能完全电离。例如:
强电解质:
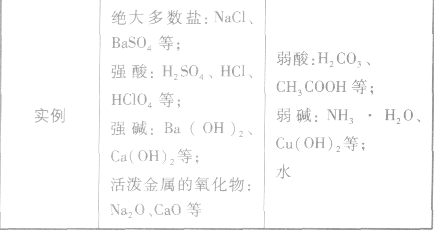
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“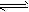 ”表示。
”表示。
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
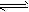 ”表示。
”表示。 强电解质和弱电解质的比较:
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如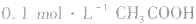 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
电解质和非电解质:
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
电解质溶液的导电性和导电能力:
1.金属靠自由电子的定向移动而导电,属于物理现象,温度升高时电阻增大,导电能力减弱。电解质溶液靠自由离子的定向移动而导电。电解质溶液(或熔融电解质)在导电的同时要发生化学变化,即被电解。
2.影响电解质溶液导电能力的因素
(1)自由移动离子浓度的大小(主要决定因素):温度一定,离子浓度越大,导电能力越强。
(2)温度:温度越高,导电能力越强(与金属导电相反)。
(3)单个离子所带电荷数:电荷数越高,导电能力越强。例如:氨水中通入少量HCl,原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱,当通入少量HCl 转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强。
3.强电解质溶液的导电能力不一定比弱电解质溶液的强。例如:较浓醋酸的导电能力比极稀HCl溶液强,这是由溶液中自南移动离子浓度大小决定的。又如:CaCO3虽为强电解质,但溶于水所得溶液极稀,自由移动离子的浓度太小,溶液导电能力极差。
1.金属靠自由电子的定向移动而导电,属于物理现象,温度升高时电阻增大,导电能力减弱。电解质溶液靠自由离子的定向移动而导电。电解质溶液(或熔融电解质)在导电的同时要发生化学变化,即被电解。
2.影响电解质溶液导电能力的因素
(1)自由移动离子浓度的大小(主要决定因素):温度一定,离子浓度越大,导电能力越强。
(2)温度:温度越高,导电能力越强(与金属导电相反)。
(3)单个离子所带电荷数:电荷数越高,导电能力越强。例如:氨水中通入少量HCl,原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱,当通入少量HCl 转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强。
3.强电解质溶液的导电能力不一定比弱电解质溶液的强。例如:较浓醋酸的导电能力比极稀HCl溶液强,这是由溶液中自南移动离子浓度大小决定的。又如:CaCO3虽为强电解质,但溶于水所得溶液极稀,自由移动离子的浓度太小,溶液导电能力极差。
发现相似题
与“现有以下物质:①铝 ②稀硝酸 ③氯化氢 ④氨气 ⑤甲烷 ⑥氢氧化钠 ⑦...”考查相似的试题有:
- 常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,(1)该溶液中存在的三个平衡体系是_______________、_____...
- 某溶液中加入BaCl2溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中A.一定含有SO42–B.一定含有Ag+C....
- 下列属于弱电解质的是A.H2SO4B.KOHC.H2OD.BaCl2
- 下列电离方程式中,正确的是( )A.NaHCO3="==" Na++ H++ CO32—B.MgCl2Mg2++ Cl2—C.H2SO42H++ SO42—D.KClO3K++Cl-+3O2-
- 下列物质中,不属于电解质的是A.铁B.硝酸C.氯化钠D.氢氧化钾
- 对电解质的叙述正确的是( )A.溶于水后得到的溶液能导电的物质B.熔融态能导电的物质C.电解所得到的物质D.在水溶液中或熔...
- 下列有关电解质的叙述,正确的是( )A.能在熔化状态下导电的物质属于电解质B.在熔化状态下不导电的化合物,一定是非电解质...
- (6分)有以下几种物质:①熔融态的食盐晶体②液态氯化氢③银④蔗糖⑤干燥的Na2CO3晶体⑥酒精⑦CO2⑧NaOH溶液,填空回答:(填序号)(1...
- 下列物质是属于非电解质的是A.NH3B.(NH4)2SO4C.Cl2D.CH3COOH
- 分类法是一种重要的学习方法.(1)请按要求对下列物质进行分类①铝粉②熔融的硝酸钾③氯气④硫酸钡固体⑤氯化氢气体⑥石灰水⑦无水...