本试题 “铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。(1)该药品中会缓慢氧化。国家规定该...” 主要考查您对氧化还原反应的配平
羧酸的通性
离子的检验
氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的配平
- 羧酸的通性
- 离子的检验
- 氧化还原反应的计算
配平简介:
化学反应方程式严格遵守质量守恒定律,书写化学反应方程式写出反应物和生成物后,往往左右两边各原子数目不相等,不满足质量守恒定律,这就需要通过配平来解决。
配平原则:
(1)电子守恒原则:反应中还原剂失去电子的总数与氧化剂得到电子的总数相等
(2)电荷守恒原则:若为离子反应,反应前后离子所带正负电荷总数相等
(3)质量守恒原则:反应前后各元素的原子个数相等
配平步骤:
(1)一标:标明反应前后化合价有变化的元素的化合价
(2)二等:通过求最小公倍数使化合价升降总值相等
(3)三定:确定氧化剂与还原剂的化学计量数
氧化剂(还原剂)化学计量数=降(升)价的最小公倍数÷1mol氧化剂(还原剂)降(升)价总数
(4)四平:用观察法配平其他物质的化学计量数
(5)五查:检查质量与电荷、电子是否分别守恒
配平技巧:
(1)逆向配平法:部分氧化还原反应、自身氧化还原反应等可用逆向配平法,即选择氧化产物、还原产物为基准物来配平(一般从反应物很难配平时,可选用逆向配平法)
例:
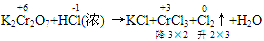
通过表明氧化产物、还原产物化合价的升降,确定CrCl3、Cl2的计量数为2和3,然后再用观察法配平。
(2)设“1”配平法:设某一反应物或生成物(一般选用组成元素较多的物质作基准物)的化学计量数为1,其余各物质的化学计量数可根据原子守恒原理列方程求得。
例:P4O+Cl2→POCl3+P2Cl6
可令P4O前的系数为1,Cl2的系数为x,则
1P4O+xCl2→POCl3+3/2P2Cl6 ,再由Cl原子守恒得2x=3+3/2×6 得x=6 即可配平
(3)零价配平法:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降总数相等,最后用观察法配平其他物质的化学计量数。
例:Fe3C+HNO3=Fe(NO3)3+CO2↑+NO2↑+H2O
复杂化合物Fe3C按照常规方法分析,无法确定其Fe和C的具体化合价,此时可令组成物质的各元素化合价为零价,根据化合价升降法配平。
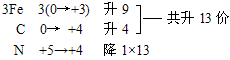
再用观察法确定物质的化学计量数。
(4)整体标价法:当某元素的原子在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零原则予以整体标价。
例:S+Ca(OH)2→CaSx+Ca2S2O3+H2O
生成物CaSx、Ca2S2O3中的Sx、S2作为一个整体标价为-2、+4价,则化合价升降关系为:
Sx 0→-2 降2×2
S2 0→+4 升4×1
即可配平。
(5)缺项配平法:一般先确定氧化剂、还原剂、氧化产物、还原产物的化学计量系数,再通过比较反应物与生成物,确定缺项(一般为H2O、H+或OH-),最后观察配平。
(6)有机氧化还原反应的配平:有机物中元素的化合价一般来讲,氢元素显+1价,氧元素显-2价,然后再根据化合价的代数和为零求酸碳元素的平均化合价。
氧化还原反应方程式配平的一般方法与步骤:
- 一般方法:从左向右配。
- 步骤:标变价,找变化,求总数,配系数。
- 标出元素化合价变化的始态和终态
- 求升价元素或降价元素化合价的变化数
- 求化合价变化数的最小公倍数,分别作为氧化剂或还原剂的系数
- 配平变价元素
- 用观察法配平其他元素
- 检查配平后的方程式是否符合质量守恒定律(离子方程式还要看电荷是否守恒)
如: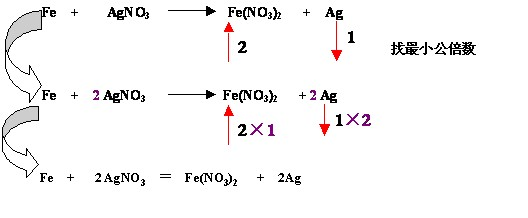
特殊技巧:
配平时若同一物质内既有元素的化合价上升又有元素的化合价下降,若从左向右配平较困难,可以采用从右向左配平,成为逆向配平法。
羧酸:
1.概念:烃基跟羧基相连构成的有机化合物叫做羧酸。一元羧酸的通式为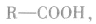 饱和一元羧酸的通式为
饱和一元羧酸的通式为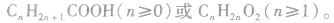
2.羧酸的分类:根据分子中烃基种类的不同,羧酸可分为脂肪酸和芳香酸等。分子中羧基与脂肪烃基相连的羧酸称为脂肪酸,如乙酸、硬脂酸;分子中羧基直接与苯环相连的羧酸称为芳香酸,如苯甲酸。
根据分子中羧基数目的不同,羧酸可分为一元羧酸、二元羧酸和多元羧酸等。分子中有一个羧基的羧酸称为一元羧酸,如乙酸;分子中有两个羧基的羧酸称为二元羧酸,如乙二酸(HOOC—COOH,俗称草酸)、对苯二甲酸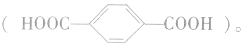
在一元羧酸里,酸分子的烃基含较多碳原子的称为高级脂肪酸,硬脂酸(C17H35COOH)、软脂酸(C15H31COOH)、油酸(C17H33COOH)都是常见的高级脂肪酸。
羟酸的性质:
1、羧酸的物理性质:
分子中碳原子数在4以下的羧酸能与水互溶。随着分子中碳链的增长,羧酸在水中的溶解度减小,直至与相对分子质量相近的烷烃溶解度相近。
羧酸分子间可以形成氢键。羧基中有两个氧原子,既可以像醇分子那样通过羟基氧和羟基氢形成氢键,也可以通过羰基氧和羟基氢形成氢键。由于羧酸分子形成氢键的机会比相对分子质量相近的醇多,所以羧酸的沸点比相应醇的沸点高。例如,乙酸和1一丙醇的相对分子质量都是60,但乙酸的沸点为117.9℃, 1一丙醇的沸点为97.2℃。
2、羧酸的化学性质
羧基由羰基和羟基组成,由于官能团之间的相互影响,使得羧酸的化学性质并不是羟基具有的化学性质和羰基具有的化学性质的简单加和。与醇羟基相比,羧基中羟基上的氢原子更易以离子形式电离出来,所以羧酸有酸性。与醛、酮的羰基相比,羧基中的羰基较难发生加成反应。羧酸很难通过催化加氢的方法被还原,用强还原剂如LiAlH4时才能将羧酸还原为相应的醇。
羧酸的主要化学性质如下:
(1)酸性
羧酸为弱电解质,羧酸、碳酸、苯酚的酸性由强到弱的顺序是: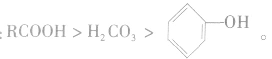 具有酸的通性。
具有酸的通性。 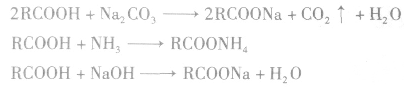
(2)酯化反应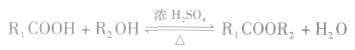
酯化反应也属于取代反应的范畴。酯化反应是制备酯的一种常用方法。
(3)形成酸酐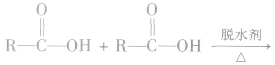
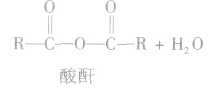
酸酐(羧酸分子间脱水的产物)可向有机化合物分 子提供酰基(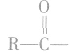 ),是良好的酰化试剂。
),是良好的酰化试剂。
5.重要的羧酸
(1)甲酸
甲酸的结构式为 ,分子中既有羧基又有醛基,所以甲酸既有羧酸的化学性质(如弱酸性、发生酯化反应),又有像醛一样的还原性(如被银氨溶液和新制氢氧化铜悬浊液氧化)。甲酸是组成最简单的羧酸,最早是从蚂蚁体内提取出来的,故又称蚁酸。甲酸是有刺激性气味的无色液体,有腐蚀性,能与水、乙醇、乙醚、甘油等互溶。甲酸在工业上可用作还原剂,在医疗上可用作消毒剂。
,分子中既有羧基又有醛基,所以甲酸既有羧酸的化学性质(如弱酸性、发生酯化反应),又有像醛一样的还原性(如被银氨溶液和新制氢氧化铜悬浊液氧化)。甲酸是组成最简单的羧酸,最早是从蚂蚁体内提取出来的,故又称蚁酸。甲酸是有刺激性气味的无色液体,有腐蚀性,能与水、乙醇、乙醚、甘油等互溶。甲酸在工业上可用作还原剂,在医疗上可用作消毒剂。
(2)乙酸
乙酸俗称醋酸,通常为无色液体,具有强烈的刺激性气味,沸点117.9℃,熔点16.60C。当温度低于 16.60c时,乙酸就凝结成像冰一样的晶体,所以纯净的乙酸又称冰醋酸。乙酸是一种重要的有机化工原料,用途极为广泛。乙酸可用于生产醋酸纤维、合成纤维(如维纶)、喷漆溶剂、香料、染料、医药以及农药等。乙酸还是人们生活中的调味剂,普通食醋中含3%~5%(质量分数)的乙酸。
目前工业上合成乙酸的主要方法是乙醛氧化法,即用醋酸锰为催化剂,用氧气或空气作氧化剂氧化乙醛生成乙酸。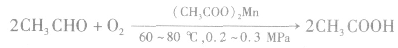
氢原子活性与物质的性质:
醇、酚、羧酸的结构中均有一OH,可分别称之为 “醇羟基”“酚羟基”和“羧羟基”。由于与这些一OH相连的基团不同,一OH受相连基团的影响就不同。故羟基上的氢原子活性也就不同,表现在性质上也相差较大,可比较如下: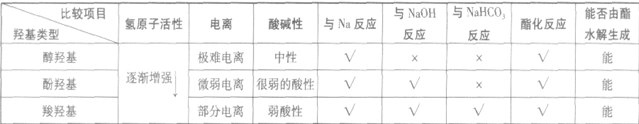
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
(2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
(3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-
 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O NH3?H2O
NH3?H2O NH4++OH-
NH4++OH- (4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-==
Fe(OH)3↓
(5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O==4Fe(OH)3;
②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
(6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
(7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==
AlO2-+2H2O
(8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2
 CuO+H2O
CuO+H2O (9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
(10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓
(11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
(12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
(13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
(14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
(15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
(16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
(17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
(18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
(19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
(20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
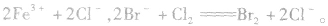 。
。
与“铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速...”考查相似的试题有:
- 配平方程式:_________An+_________By-=_________Ax-+Bm
- 下列叙述正确的是 A.发生化学反应时失去电子越多的金属原子,还原能力越强B.金属阳离子被还原后,不一定得到金属的单质C....
- xR2++yH++O2 mR3++2H2O中,对m和R3+判断正确的是A.m=4,R2+是氧化剂B.2m=y,R3+是氧化剂C.m=4,R3+是氧化产物D.m=,R3+是...
- 铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下...
- (7分)有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、Na2SO4、KOH中的一种或几种,为证明其组成,进行如下实验:(1)取少量...
- 在实验室,称取一定量的粗盐经溶解、过滤、结晶等操作,可得到较纯净的食盐。下列图示对应的操作不规范的是
- 物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:⑴为将下列物质提纯(括号中的为杂质),应...
- 已知A、B、C、D、E分别为Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。现将它们相互反应情况列表如下(表中“...
- 工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。完成下列填空:(1)气体A中的大气污染物可选用下...
- (浙江省余姚中学08-09学年上学期高三第一次质量检测,化学,18)可用于区别Na2S、Na2SO3、Na2SO4、Na2CO3、Na2SiO3、Na2S2O3...