本试题 “著名化学家侯德榜改革国外的纯碱生产工艺,发明的新生产流程可简要表示如下:(1)上述生产纯碱的方法称___,副产品的一种用途为___;(2)沉淀池中发生的化学反...” 主要考查您对氨气
工业生产纯碱
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氨气
- 工业生产纯碱
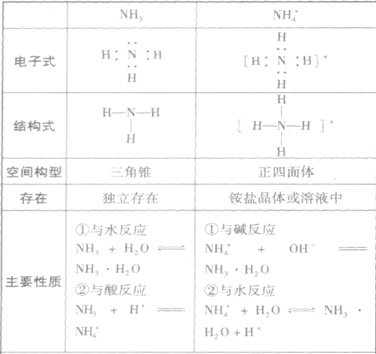
氨:
NH3的电子式为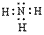 ,结构式为
,结构式为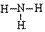 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为: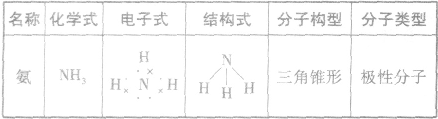
氨的物理性质和化学性质:
1.物理性质:
氨是无色、有刺激性气味的气体,比空气轻;氨易液化,在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热。液态氨气化时要吸收大量的热,使周围的温度急剧下降;氨气极易溶于水,在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);氨对人的眼、鼻、喉等粘膜有刺激作用,若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
2.化学性质:
(1)与水反应, ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。
(2)与酸反应生成铵盐反应实质为:
反应原理拓展NH3分子中N原子有一对孤电子,能够跟有空轨道的H+形成配位键: 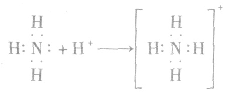
(3)具有还原性  (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
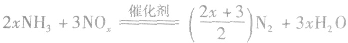 (治理氮氧化物污染)
(治理氮氧化物污染)
(4)与CO2反应制尿素 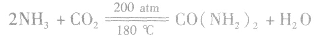
(5)配合反应
 的比较:
的比较:
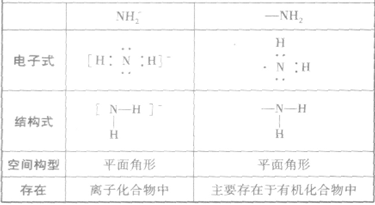
氨的结构与性质的关系总结:

氨的用途:
(1)氨是氮肥工业及制造硝酸、铵盐、纯碱等的重要原料。
(2)氨也是有机合成工业(如制尿素、合成纤维、染料等)上的常用原料。
(3)氨还可用作制冷剂。
对实验室制氨气常见问题的解释:
l.制取氨气时为什么用的铵盐一般是氯化铵而不是硝铵、硫铵或碳铵实验室制氨气用 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为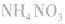 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应: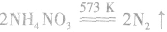
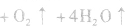 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用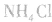 。
。
2.不用铵盐与强碱反应能否制取氨气能。
①加热浓度在20%以上的浓氨水,若浓度不够可加人适量固体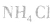 和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 
②将浓氨水滴入盛有固体烧碱或生石灰(CaO)的烧瓶中,使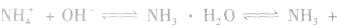
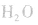 平衡右移,放出
平衡右移,放出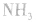 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低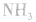 ,在水中的溶解度。
,在水中的溶解度。
③将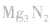 溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 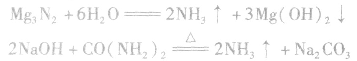
3.为什么制NH3用Ca(OH)2而不用NaOH ①固体NaOH易吸湿结块,不易与铵盐混合充分而反应;②在加热条件下,NaOH易腐蚀玻璃仪器。
4.制NH3的装置有哪些注意事项
①收集装置和发生装置的试管和导管必须是干燥的,因为氨气易溶于水;
②发生装置的试管口略向下倾斜,以免生成的水倒流使试管炸裂;
③导管应插入收集装置的底部,以排尽装置中的空气;
④收集NH3的试管口塞一团棉花,作用是防止NH3与空气形成对流,使收集的NH3较纯,还可防止NH3逸散到空气中。
5.用什么方法收集NH3只能用向下排空气法,因为NH3极易溶于水,密度又比空气小。
6.怎样收集干燥的NH3将NH3通过盛有碱石灰或固体NaOH的干燥管,但不能选用浓 、无水
、无水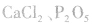 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。
7.怎样检验NH3已充满试管把湿润的红色石蕊试纸放在试管口处,若试纸变蓝,则NH3已充满;把蘸有浓盐酸的玻璃棒接近试管口,若产生大量白烟,则NH3已充满。
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4
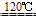 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑ 将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C
 Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3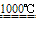 Na2CO3+CaS
Na2CO3+CaS 存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3
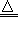 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑ 氨碱法生产原理:
氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
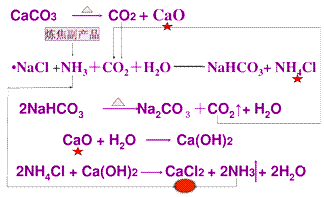
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
与“著名化学家侯德榜改革国外的纯碱生产工艺,发明的新生产流程...”考查相似的试题有:
- 如图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )A.CO2(...
- 化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况.下列反应中属于这种情况的是( )A.过量的MnO2与浓...
- 下列实验过程中,始终无明显现象的是[ ]A.NO2通入FeSO4溶液中B.CO2通入CaCl2溶液中C.SO2通入已酸化的Ba(NO3)2溶液中D.NH3...
- 根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全...
- 现有3种化合物A、B、C均含短周期元素R,其转化关系如下图所示。(1)若A由第三周期2种元素组成。常温下,0.1 mol/L X溶液的p...
- 喷泉是一种常见的自然现象,其产生的原因是存在压强差。(1)实验室制取氨气的化学方程式___________________。①用图1装置进行...
- 如图是进行气体性质实验的常用装置,下列对有关实验现象的说法中不正确的是( )A.若水槽中是NaOH溶液,试管中是Cl2,可看到...
- 通常情况下,下列各组物质能够共存,能用碱石灰来干燥,也能用浓硫酸干燥的气体是[ ]A.NH3、N2、H2B.HCl、NH3、CO2C.H2、O...
- 工业生产纯碱的工艺流程示意图如下:完成下列填空:(1)沉淀剂A来源于石灰窑厂,写出A、B的化学式。A__________________,B_...
- 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制 碱法”两种工艺。请按要求回答问题:(1)“氨碱法”产生大量C...