本试题 “已知:还原性HSO3->I-,氧化性IO3->I2。(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并标出电子转移的方向和数目。____NaIO3+____NaHS...” 主要考查您对氧化还原反应的配平
氧化还原反应的表示方法
氧化产物、还原产物
氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的配平
- 氧化还原反应的表示方法
- 氧化产物、还原产物
- 氧化还原反应的计算
配平简介:
化学反应方程式严格遵守质量守恒定律,书写化学反应方程式写出反应物和生成物后,往往左右两边各原子数目不相等,不满足质量守恒定律,这就需要通过配平来解决。
配平原则:
(1)电子守恒原则:反应中还原剂失去电子的总数与氧化剂得到电子的总数相等
(2)电荷守恒原则:若为离子反应,反应前后离子所带正负电荷总数相等
(3)质量守恒原则:反应前后各元素的原子个数相等
配平步骤:
(1)一标:标明反应前后化合价有变化的元素的化合价
(2)二等:通过求最小公倍数使化合价升降总值相等
(3)三定:确定氧化剂与还原剂的化学计量数
氧化剂(还原剂)化学计量数=降(升)价的最小公倍数÷1mol氧化剂(还原剂)降(升)价总数
(4)四平:用观察法配平其他物质的化学计量数
(5)五查:检查质量与电荷、电子是否分别守恒
配平技巧:
(1)逆向配平法:部分氧化还原反应、自身氧化还原反应等可用逆向配平法,即选择氧化产物、还原产物为基准物来配平(一般从反应物很难配平时,可选用逆向配平法)
例:
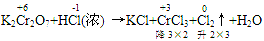
通过表明氧化产物、还原产物化合价的升降,确定CrCl3、Cl2的计量数为2和3,然后再用观察法配平。
(2)设“1”配平法:设某一反应物或生成物(一般选用组成元素较多的物质作基准物)的化学计量数为1,其余各物质的化学计量数可根据原子守恒原理列方程求得。
例:P4O+Cl2→POCl3+P2Cl6
可令P4O前的系数为1,Cl2的系数为x,则
1P4O+xCl2→POCl3+3/2P2Cl6 ,再由Cl原子守恒得2x=3+3/2×6 得x=6 即可配平
(3)零价配平法:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降总数相等,最后用观察法配平其他物质的化学计量数。
例:Fe3C+HNO3=Fe(NO3)3+CO2↑+NO2↑+H2O
复杂化合物Fe3C按照常规方法分析,无法确定其Fe和C的具体化合价,此时可令组成物质的各元素化合价为零价,根据化合价升降法配平。
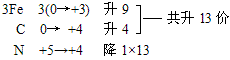
再用观察法确定物质的化学计量数。
(4)整体标价法:当某元素的原子在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零原则予以整体标价。
例:S+Ca(OH)2→CaSx+Ca2S2O3+H2O
生成物CaSx、Ca2S2O3中的Sx、S2作为一个整体标价为-2、+4价,则化合价升降关系为:
Sx 0→-2 降2×2
S2 0→+4 升4×1
即可配平。
(5)缺项配平法:一般先确定氧化剂、还原剂、氧化产物、还原产物的化学计量系数,再通过比较反应物与生成物,确定缺项(一般为H2O、H+或OH-),最后观察配平。
(6)有机氧化还原反应的配平:有机物中元素的化合价一般来讲,氢元素显+1价,氧元素显-2价,然后再根据化合价的代数和为零求酸碳元素的平均化合价。
氧化还原反应方程式配平的一般方法与步骤:
- 一般方法:从左向右配。
- 步骤:标变价,找变化,求总数,配系数。
- 标出元素化合价变化的始态和终态
- 求升价元素或降价元素化合价的变化数
- 求化合价变化数的最小公倍数,分别作为氧化剂或还原剂的系数
- 配平变价元素
- 用观察法配平其他元素
- 检查配平后的方程式是否符合质量守恒定律(离子方程式还要看电荷是否守恒)
如: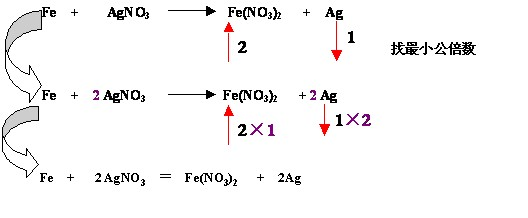
特殊技巧:
配平时若同一物质内既有元素的化合价上升又有元素的化合价下降,若从左向右配平较困难,可以采用从右向左配平,成为逆向配平法。
就是表示出反应物中原子或离子间的电子转移的方向和数目。
表示方法:
(1)双线桥法:此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原关系。双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团。如:

注:箭头表示指向;标“得或失”;箭头表示反应前后变化,不表示电子转移方向
(2)单线桥法:在氧化还原反应中,有电子发生转移(得失或偏移),也就是在反应物中有元素电子发生得失或偏移,这时用一条带箭头的曲线从失去电子的元素指向得到电子的元素,并在“桥”上标出转移的电子数,这种表示方法叫单线桥法。 如:

注:箭头指向;不标“得或失”
双线桥法步骤:
(1)标变价:明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
(2)连双线:将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止要求元素对元素)
(3)标得失:
①标电子转移或偏离数:明确标出得失电子数,格式为“得/失发生氧化还原反应原子个数×单位原子得失电子数”
②标化合价变化:一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
③标出元素反应类型:一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
④检查得失电子守恒:检查得失电子数是否相等,如不相等则重新分析。
单线桥法步骤:
(1)标价态:明确标明发生氧化还原反应的元素的化合价
(2)连单线:连接方程式左边的氧化剂与还原剂,箭头一律指向氧化剂
(3)不注得失:标出转移的电子的总数,这里不用像双线桥那样,仅需直接标出电子总数
在氧化还原反应中,还原剂在反应中失电子(或偏移离子)后被氧化后的产物,与还原产物相对应,是发生氧化反应的产物,与氧化元素对应。
例:WO3+H2——W+H2O,H2O即氧化产物。
还原产物:
在氧化还原反应中,氧化剂得电子被还原后的产物,与氧化产物相对应,是发生还原反应的产物,还原元素对应。
例:WO3+3H2——W+3H2O,W即还原产物。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
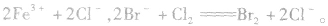 。
。
与“已知:还原性HSO3->I-,氧化性IO3->I2。(1)在NaIO3溶液中滴加...”考查相似的试题有:
- 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O。KMnO4、Na2CO3、Cu...
- 铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O22PbO+2SO2;③制粗铅:PbO+CPb+CO;PbO+COPb+C...
- 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过以下反应制得(1)配平上述反应的化学方程式(将化学计...
- NO2通过盛有水的洗气瓶,转移0.03mol电子时,参加反应的NO2气体在标准状况下的体积为A.224mLB.336mLC.448mLD.1008mL
- 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。(1)利用甲烷催化还原氮氧化物。已知:CH4(g)+4NO2(g)=4NO(g)+CO2...
- 某体系中存在如下反应:①H2S+4H2O-8e → SO42-+10H+ ②2IO3-+12 H++10e → I2+6H2O(1)反应①中H2S做__________剂,反...
- 用双线桥表示下列反应中得失电子的情况,并按要求回答:3FeO + 10HNO3= 3Fe(NO3)3 + NO↑ + 5H2O.(1)氧化剂是 ;氧化产物...
- 下表是元素周期表前四周期的一部分,X、Y、Z、R、Q、 W、J是7种元素的代号。回答下列问题时,涉及元素书写的 请用相应的元素...
- 把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列...
- amol FeO与bmol Cu2S投入到Cmol/L的硝酸中恰好完全反应,生成NO共消耗硝酸VL,所得澄清溶液成分可看作为Fe(NO3)3、Cu(NO3...