本试题 “某酸式盐NaHY的水溶液显碱性,HY-的电离方程式为___________ ; HY-的水解离子方程式为_________ ;酸式盐NaHY的水溶液显碱性的原因是:__________ 。” 主要考查您对电离方程式
溶液的酸碱性
水解方程式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电离方程式
- 溶液的酸碱性
- 水解方程式
定义:
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“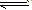 ” 。
” 。
.
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“
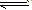 ” 。
” 。.
电离方程式的书写:
1.强电解质的电离用“ ”,弱电解质的电离用 “
”,弱电解质的电离用 “ ”。
”。
2.多元弱酸分步电离,分步持写电离方程式,一般只写第一步;多元弱碱也是分步电离的,但可按一步完全电离写出。例如:
氧硫酸: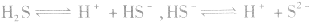
氢氧化铁:
3.强酸的酸式盐完全电离,弱酸的酸式盐中酸式酸根不完全电离。例如: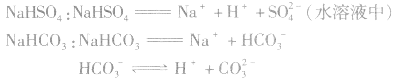
说明:在熔融状态时,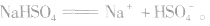
4.某些复盐能完全电离。例如:
溶液的酸碱性:
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
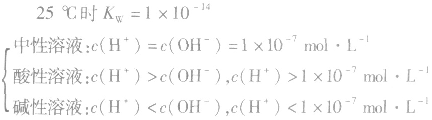
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
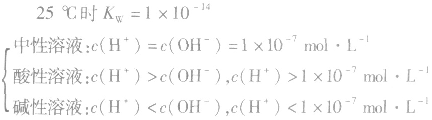
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
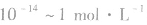 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: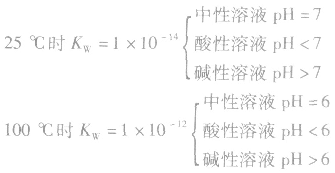
水解方程式:
1、定义:表示盐水解的式子。
2、书写水解方程式的注意事项:
(1)找出盐类组成中会发生水解的离子(弱酸阴离子或弱碱阳离子),直接写出盐类水解的离子方程式。
(2)盐类的水解反应是中和反应的逆反应,中和反应的程度很大,水解反应的程度很小,故写盐类的水解反应方程式或离子方程式时,一般不写“=”而写“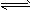 ”。
”。
(3)一般盐类水解的程度很小,水解产物也少,通常不生成沉淀或气体,也不发生分解。在书写盐类水解的离子方程式时一般不标“↑”或“↓”,也不把生成物(如NH3·H2O、H2CO3)写成其分解产物的形式。
(4)多元弱酸的盐中弱酸根离子分步水解,第一步比较容易发生,第二步比第一步难。水解时以第一步为主。多元弱酸的水解反应式应分步书写,而多元弱碱的水解反应不分步书写。
(5)某些盐溶液在混合时,由于一种盐的阳离子和另一种盐的阴离子都能发生水解,水解后溶液的性质相反,它们在一起时就能相互促进对方的水解,使两种离子的水解趋于完全。称为双水解。如:铝盐和碳酸盐混合:
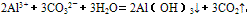 ,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
1、定义:表示盐水解的式子。
2、书写水解方程式的注意事项:
(1)找出盐类组成中会发生水解的离子(弱酸阴离子或弱碱阳离子),直接写出盐类水解的离子方程式。
(2)盐类的水解反应是中和反应的逆反应,中和反应的程度很大,水解反应的程度很小,故写盐类的水解反应方程式或离子方程式时,一般不写“=”而写“
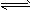 ”。
”。 (3)一般盐类水解的程度很小,水解产物也少,通常不生成沉淀或气体,也不发生分解。在书写盐类水解的离子方程式时一般不标“↑”或“↓”,也不把生成物(如NH3·H2O、H2CO3)写成其分解产物的形式。
(4)多元弱酸的盐中弱酸根离子分步水解,第一步比较容易发生,第二步比第一步难。水解时以第一步为主。多元弱酸的水解反应式应分步书写,而多元弱碱的水解反应不分步书写。
(5)某些盐溶液在混合时,由于一种盐的阳离子和另一种盐的阴离子都能发生水解,水解后溶液的性质相反,它们在一起时就能相互促进对方的水解,使两种离子的水解趋于完全。称为双水解。如:铝盐和碳酸盐混合:
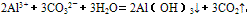 ,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。盐类水解方程式的书写:
一般来说,盐类水解的程度不大,应该用可逆号“ ”表示,盐类水解一般不会产生沉淀和气体,所以不用“↑”“↓”符号表示。
”表示,盐类水解一般不会产生沉淀和气体,所以不用“↑”“↓”符号表示。
1.一元弱酸的强碱盐和一元弱碱的强酸盐的水解。 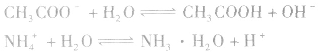
2.多元弱酸的强碱盐的水解是分步进行的,不能合并,以第一步为主。 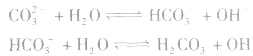
3.多元弱碱的强酸盐的水解。 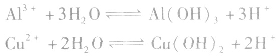
4.弱酸的铵盐的水解。 
5.完全双水解的离子间的反应用“==”表示,标明“↑”“↓”符号。如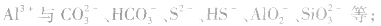


发现相似题
与“某酸式盐NaHY的水溶液显碱性,HY-的电离方程式为___________ ...”考查相似的试题有:
- 下列电离方程式错误的是[ ]A、CaCl2= Ca2++ 2Cl-B、NaHSO4= Na++ H++ SO42-C、NaHCO3= Na++ HCO3-D、KClO3= K++ Cl-+ 3O2-
- 现有部分短周期元素的性质或原子结构如下表:(1)写出元素X的离子结构示意图______________。写出元素Z 的气态氢化物的电子式_...
- 常温下,pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01 mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶...
- 下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是( ) A.CH3Cl B. C. D. E.
- 草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.01 mol·L-1KHC2O4溶液中,下列关系正确的是 ( )A.c (K+) + c (H+) =" c" (HC2O...
- 相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO溶液的说法中正确的是( )A...
- 常温下有浓度均为0.5 mol·L-1的四种溶液:①碳酸钠溶液②碳酸氢钠溶液③盐酸④氨水。请根据题目要求回答下列问题:(1)上述溶液中...
- 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是A.饱和纯碱(Na2CO3)溶液中:c(Na+)=2c(CO32-)B.pH=4的醋酸中:c(H...
- 常温下测得NaA盐溶液的PH值是10,有关盐NaA的说法正确的是 ( )A.强酸弱碱盐B.强碱弱酸盐C.强酸强碱盐D.弱酸弱碱盐
- (6分)某溶液经检测只含有NH4+、Cl-、H+、OH-四种离子,(1)若该溶液中只有一种溶质,则该溶质是 (写化学式)。(2)若该...