本试题 “为建设美丽泉城,迎接第十届艺术节的到来,环境卫生整治是当前重要的工作之一,我市出现的某些环境问题也引起了人们的高度关注,如:马路烧烤、小清河污染、...” 主要考查您对酸雨
pH值的测定
氧化反应
分解反应
化合反应
置换反应
复分解反应
物质组成元素的质量比
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酸雨
- pH值的测定
- 氧化反应
- 分解反应
- 化合反应
- 置换反应
- 复分解反应
- 物质组成元素的质量比
概念:
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2 SO2
SO2
二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2 2NO
2NO
一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2
 SO2
SO2 二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2
 2NO
2NO 一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
知识拓展:
1. 酸雨区
某地收集到酸雨样品,还不能算是酸雨区,因为一年可有数十场雨,某场雨可能是酸雨,某场雨可能不是酸雨,所以要看年均值。目前我国定义酸雨区的科学标准尚在讨论之中,但一般认为:年均降水pH高于5.65,酸雨率是0-20%,为非酸雨区;pH在5.30--5.60之间,酸雨率是10--40%,为轻酸雨区;pH在5.00--5.30之间,酸雨率是30-60%,为中度酸雨区;pH在4.70--5.00之间,酸雨率是50-80%,为较重酸雨区;pH小于4.70,酸雨率是70-100%,为重酸雨区。这就是所谓的五级标准。其实,北京、拉萨、西宁、兰州和乌鲁木齐等市也收集到几场酸雨,但年均pH和酸雨率都在非酸雨区标准内,故为非酸雨区。
2. 我国三大酸雨区
我国酸雨主要是硫酸型
我国三大酸雨区分别为:
(1)西南酸雨区:是仅次于华中酸雨区的降水污染严重区域。
(2)华中酸雨区:目前它已成为全国酸雨污染范围最大,中心强度最高的酸雨污染区。
(3)华东沿海酸雨区:它的污染强度低于华中、西南酸雨区。
pH值:
氢离子浓度指数是指溶液中氢离子的总数和总物质的量的比。它的数值俗称“pH值”。表示溶液酸性或碱性程度的数值。
pH试纸的使用:
(1)内容测定溶液pH的最简便方法是使用pH试纸,这种试纸在不同酸碱度的溶液里,显示不同的颜色。
(2)操作把pH试纸放在表面皿上,再用玻璃棒蘸取待测溶液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对比,便可知道溶液的pH。
(3)提示
①pH试纸不能用水湿润,否则测得的pH可能会不准确,测碱溶液会导致pH低于实际值,测酸溶液会导致pH高于实际值。
②不能直接将pH试纸浸入待测液中,因为用试纸直接蘸待测液会使待测液受到污染。
④用广泛pH试纸测得的pH数值一般为整数。
④显色时间不能太长,以半分钟内的变化为准。
⑤实验完毕后,应对使用的仪器进行洗涤后按正确的方法放置到原来的位置,试剂瓶应标签向外放在药品橱中,最后擦净实验桌面。
pH测定:
有很多方法来测定溶液的pH值:
1.使用pH指示剂。在待测溶液中加入pH指示剂,不同的指示剂根据不同的pH值会变化颜色,根据指示剂的研究就可以确定pH的范围。滴定时,可以作精确的pH标准。
2.使用pH试纸。pH试纸有广泛试纸和精密试纸,用玻璃棒蘸一点待测溶液到试纸上,然后根据试纸的颜色变化对照标准比色卡可以得到溶液的pH。pH试纸不能够显示出油份的pH,原因是pH试纸以氢铁制成并以氢铁来测定待测溶液的pH值,而油中不含氢铁。
3.使用pH计。pH计是一种测定溶液pH值的仪器,它通过pH选择电极(如玻璃电极)来测定出溶液的pH。pH计可以精确到小数点后两位。
氢离子浓度指数是指溶液中氢离子的总数和总物质的量的比。它的数值俗称“pH值”。表示溶液酸性或碱性程度的数值。
pH试纸的使用:
(1)内容测定溶液pH的最简便方法是使用pH试纸,这种试纸在不同酸碱度的溶液里,显示不同的颜色。
(2)操作把pH试纸放在表面皿上,再用玻璃棒蘸取待测溶液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对比,便可知道溶液的pH。
(3)提示
①pH试纸不能用水湿润,否则测得的pH可能会不准确,测碱溶液会导致pH低于实际值,测酸溶液会导致pH高于实际值。
②不能直接将pH试纸浸入待测液中,因为用试纸直接蘸待测液会使待测液受到污染。
④用广泛pH试纸测得的pH数值一般为整数。
④显色时间不能太长,以半分钟内的变化为准。
⑤实验完毕后,应对使用的仪器进行洗涤后按正确的方法放置到原来的位置,试剂瓶应标签向外放在药品橱中,最后擦净实验桌面。
pH测定:
有很多方法来测定溶液的pH值:
1.使用pH指示剂。在待测溶液中加入pH指示剂,不同的指示剂根据不同的pH值会变化颜色,根据指示剂的研究就可以确定pH的范围。滴定时,可以作精确的pH标准。
2.使用pH试纸。pH试纸有广泛试纸和精密试纸,用玻璃棒蘸一点待测溶液到试纸上,然后根据试纸的颜色变化对照标准比色卡可以得到溶液的pH。pH试纸不能够显示出油份的pH,原因是pH试纸以氢铁制成并以氢铁来测定待测溶液的pH值,而油中不含氢铁。
3.使用pH计。pH计是一种测定溶液pH值的仪器,它通过pH选择电极(如玻璃电极)来测定出溶液的pH。pH计可以精确到小数点后两位。
定义:
氧化反应:物质与氧发生的化学反应,如S+O2 SO2;H2+CuO
SO2;H2+CuO H2O+Cu.
H2O+Cu.
氧化反应与缓慢氧化:
氧化反应:物质与氧发生的化学反应,如S+O2
 SO2;H2+CuO
SO2;H2+CuO H2O+Cu.
H2O+Cu.氧化反应与缓慢氧化:
| 氧化反应 | 缓慢氧化 | |
| 概念 | 物质与氧(包括氧气)发生的化学反应 | 物质与氧气发生的缓慢的,不易察觉的氧化反应 |
| 举例 | 所有与氧气发生的反应 | 铁生锈,食物腐烂 |
| 联系 | 氧化反应包括剧烈氧化和缓慢氧化两种 | |
| 相同点 | ①都是氧化反应②都放出热量 | |
概念:
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O 2H2↑+O2↑
2H2↑+O2↑
2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3 CaO+CO2↑
CaO+CO2↑
⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3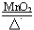 2KCl+3O2↑
2KCl+3O2↑
⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4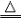 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;
2H3PO4 H4P2O7+H2O↑
H4P2O7+H2O↑
3H3PO4 H5P3O10+2H2O↑
H5P3O10+2H2O↑
2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑
K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O
 2H2↑+O2↑
2H2↑+O2↑2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3
 CaO+CO2↑
CaO+CO2↑ ⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3
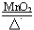 2KCl+3O2↑
2KCl+3O2↑⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4
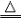 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ ⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4
 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;2H3PO4
 H4P2O7+H2O↑
H4P2O7+H2O↑ 3H3PO4
 H5P3O10+2H2O↑
H5P3O10+2H2O↑ 2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3
 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
概念:指的是由两种或两种以上的物质生成一种新物质的反应。其中部分反应为氧化还原反应,部分为非氧化还原反应。 此外,化合反应一般释放出能量。
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2 CO2
CO2
3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2 2NaCl
2NaCl
4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2 2H2O
2H2O
5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2 SO2
SO2
10.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2
 CO2
CO2 3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2
 2NaCl
2NaCl 4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2
 2H2O
2H2O 5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2
 SO2
SO210.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气
 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4概念:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
| 规律 | 发生条件 | 实例 |
| H2+金属氧化物→金属+水 | ①加热 ②K、Ca、Na、Mg、Al等的氧化物除外 |
H2+CuO Cu+H2O Cu+H2O3H2+Fe2O3 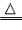 2Fe+3H2O 2Fe+3H2O |
| 碳+金属氧化物→金属+CO2 | ①高温 ②K、Ca、Na、Mg、Al等的氧化物除外 |
C+2CuO 2Cu+CO2↑ 2Cu+CO2↑3C+2Fe2O3  4Fe+3CO2↑ 4Fe+3CO2↑ |
| 金属+酸→盐+氢气 | ①浓硫酸,硝酸具有氧化性,和金属反应不生成氢气; ②在金属活动性顺序中排在氢前面的金属才能置换出酸中的氢 |
Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4(稀)==ZnSO4+H2↑ 2Al+3H2SO4(稀)==Al2(SO4)3+3H2↑ |
| 金属+盐→新盐+新金属 | ①盐必须能溶于水 ②在金属活动性顺序表中,排在前面的金属才能置换出后面的金属 ③钾、钙、钠很活泼,与盐溶液反应不能置换出金属 |
Cu+Hg(NO3)2==Hg+Cu(NO3)2 Fe+CuSO4=FeSO4+Cu |
复分解反应:
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
| 规律 | 发生的条件 |
| 金属氧化物+酸 | 生成物中有水,一般都能反应 |
| 酸+碱→盐+水 | 中和反应,有水生成,一般都能反应 |
| 酸+盐→新酸+新盐 | 生成物种有沉淀,气体或水 |
| 碱+盐→新碱+新盐 | 生成物种有沉淀,气体或水 |
| 盐1+盐2→新盐1+新盐2 | 生成物种有沉淀 |
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
定义:
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=
(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为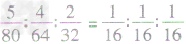 =1:1:1
=1:1:1
利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=

(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比
 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为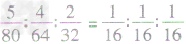 =1:1:1
=1:1:1利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
发现相似题
与“为建设美丽泉城,迎接第十届艺术节的到来,环境卫生整治是当...”考查相似的试题有:
- 低碳经济是一种以低能耗和高效能等为主要特征,以较少的温室气体排放获得较大产出的新经济发展模式。请问:(1)近年来大气中...
- 酸雨是与大气污染有关的三大环境问题之一.请简述酸雨形成的原因及酸雨的危害.
- 根据我国环保部2011年11月发布的《环境空气质量标准》(三次征求意见稿),基本监控项目中增设了一项空气污染物浓度限值,该...
- 下列做法有利于减轻环境污染的是A.焚烧废弃塑料B.随意丢弃废旧电池C.火力发电厂将废气高空排放D.我市加速地铁、轻轨、环...
- 碱式氯化铝是某种高效净水剂的主要成分。实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝的过程...
- 下列叙述正确的是:①分子是保持物质性质的一种粒子 ②原子是不能再分的一种粒子 ③化合反应一定生成化合物 ④分解反应一定生成单...
- 现有10 种物质:铁、铜、木炭、CuO 、CaCO3、H2SO4、Ba(OH)2、NaOH 、NaCl 和AgCl 。(1) 有人根据不同的标准进行如下分类,请...
- 炎炎夏日,很多同学喜欢吃水果味的雪糕.雪糕公司在制造这类雪糕时,大多不用新鲜水果,如制造菠萝雪糕时,在原料中加入一种...
- 葡萄中含有丰富的白藜芦醇(化学式为C14H12O3).它具有抗癌作用,能抑制癌细胞的增生.下列有关白藜芦醇的说法中正确的是( ...
- 维生素C(化学式C6H8O6)主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗能力,近年来科学家还发现维生...