本试题 “按要求回答(1)硬水与软水相比,是因为硬水中含有较多的可溶性______化合物,把等量的肥皂水分别加到等量的硬水、软水中,泡沫多的为______.在净水器中装有...” 主要考查您对硬水和软水
水的净化
固体溶解度
金属的化学性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 硬水和软水
- 水的净化
- 固体溶解度
- 金属的化学性质
定义:
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
定义:
清除水中不好的或不需要的杂质,使水达到纯净的程度。
四种净化水的方法,原理,作用:
| 净化水的方法 | 原理 | 作用 |
| 沉淀 | 食难溶性的杂质沉淀下来,并与水分层 | 使难溶性大颗粒沉降或加入明矾,形成的胶状物吸附杂质沉降 |
| 过滤 | 把液体与难溶于液体的固体物质分离 | 除去难溶性杂质 |
| 吸附 | 利用物质的吸附作用,吸附水中一些难溶性杂质,臭味和色素 | 除去难溶性杂质,部分可溶性杂质,臭味和色素 |
| 蒸馏 | 通过加热的方法使水变成水蒸气后冷凝成水 | 除去可溶性杂质,使硬水软化 |
水净化的方法:
吸附,沉淀,过滤,蒸馏,杀菌
吸附:常用明矾和活性炭,明矾溶于水后形成胶状物吸附水中的悬浮物,
活性炭不仅可以吸附水中的悬浮物,还可以吸附在水中有异味的物质和色素
沉淀:水中悬浮物别吸附后形成密度大的颗粒,从而使杂质沉淀
过滤:除去水中不溶性的杂质
蒸馏:除去可溶性杂质的方法
杀菌:常用杀毒剂:漂白粉,氯气以及新型消毒剂二氧化氯等
吸附、沉淀、过滤和蒸馏中单一操作净化程度较高的是蒸馏。综合运用时,按吸附→沉淀→过滤→蒸馏的顺序操作净化效果更好
加絮凝剂(明矾)与活性炭净水的比较:
| 净化水的方法 | 原理 | 能除去的杂质 |
| 明矾净水 | 明研溶于水后形成胶状物质,对杂质进行吸附,将微小颗粒吸附在一起形成大的固体颗粒而沉阵下来 | 不溶于水的微小固体颗粒 |
| 活性炭净水 | 利用内部疏松多孔的结构来吸附水中的微小颗粒和一些可溶于水的杂质 | 不溶于水的微小固体颗粒和部分能溶于水的杂质以及气味,颜色等 |
自来水厂净化水的过程图及步骤
1、净化过程图
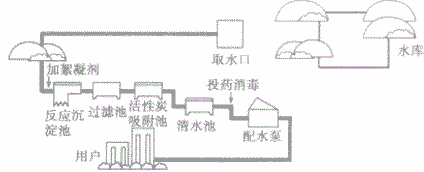
2、自来水净化步骤
①从水库中取水。
②加絮凝剂(主要是明矾),使悬浮的小颗粒状杂质被吸附凝聚。
③在反应沉淀池中沉降分离,使水澄清
④将沉淀池中流出的较澄清的水通入过滤池中,进一步除去不溶性杂质。
⑤再将水引人活性炭吸附池中,除去水中的臭味和残留的颗粒较小的不溶性杂质。
⑥细菌消毒(常用通入氯气的办法)。它是一个化学变化过程,因为除去病菌的过程.就是把病菌变成其他物质的过程。
⑦杀菌后的水就是洁净、可以饮用的自来水,通过配水泵供给用户,但水中仍然含有可以溶于水的一些杂质,所以还是混合物。
概念:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
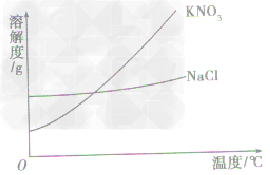
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)

(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
金属的化学性质:
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
2.金属与酸的反应
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
常见金属能与氧气反应,也能与盐酸,硫酸及盐溶液反应。
常见金属的化学性质:
1.金属和氧气的反应
| 金属 | 在空气中 | 在氧气中 | 方程式 |
| 镁 | 常温下表面逐渐变暗。点燃 剧烈燃烧,发出耀眼的白光, 生成白色固体 |
点燃,剧烈燃烧,发出耀 眼的白光,生成白色固体 |
2Mg+O2 2MgO 2MgO |
| 铝 | 常温下,铝表而变暗,生成一 层致密氧化膜,保护铝不再被腐蚀 |
点燃。剧烈燃烧,火星四射, 放出大量的热,生成白色固体 |
4Al+3O2 2Al2O3 2Al2O3 |
| 铁 | 持续加热发红,离火变冷 | 火星四射,放出大量的热, 生成黑色固体 |
3Fe+2O2 Fe3O4 Fe3O4 |
| 铜 | 加热,生成黑色物质,在潮湿的 空气中,生成铜绿而被腐蚀 |
加热,生成黑色固体 | 2Cu+O2 2CuO 2CuO |
| 金 | 即使在高温也不和氧气反应 | —— | |
| 结论 | 大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同 | ||
2.金属与酸的反应
| 盐酸 | 稀硫酸 | 反应现象(两种酸中相同) | |
| 镁 | Mg+2HCl==MgCl2+H2↑ | Mg+H2SO4==MgSO4+H2↑ | 反应比较剧烈,产生大量 气泡,溶液仍为无色,生成 的气体能够燃烧,并且产 生淡蓝色火焰 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4==Al2(SO4)+3H2↑ | |
| 锌 | Zn+2HCl==H2↑+ZnCl2 | Zn+H2SO4==ZnSO4+H2↑ | 反应缓慢,有气泡产生,溶 液由无色逐渐变为浅绿色, 生成的气体能够燃烧,并且 产生淡蓝色火焰 |
| 铁 | Fe+2HCl==FeCl2+H2↑ | Fe+H2SO4==FeSO4+H2↑ | |
| 铜 | 不反应 | 不反应 | 无 |
3.金属与盐的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜溶液、硝酸银溶液、氯化钠溶液中,观察现象
| CuSO4溶液 | AgNO3溶液 | NaCl溶液 | |
| 锌 | 锌表面有一层红色金属析出,溶液由蓝色变为无色 Zn+CuSO4==ZnSO4+Cu |
锌表面有一层银白色金属析出 Zn+2AgNO3==Zn(NO3)2+2Ag |
无变化,不反应 |
| 铁 | 铁表面有一层红色金属析出,溶液由蓝色变为浅绿色 Fe+CuSO4==FeSO4+Cu |
铁表面有一层银白色金属析出,溶液由无色变为浅绿色 Fe+2AgNO3==Fe(NO3)2+2Ag |
无变化,不反应 |
| 铜 | 无变化,不反应 | 铜表面有一层银白色金属析出,溶液由无色变为蓝色 Cu+2AgNO3==Cu(NO3)2+2Ag |
无变化,不反应 |
易错点:
一、(1)一般在金属活动性顺序表中排在氢前面的金属(也叫活泼金属)能置换出酸中的氢;排在氢后面的金属则不能,如铜、银与盐酸、稀硫酸都不反应。
(2)浓硫酸和硝酸与金属反应不生成氢气,因为它们有很强的氧化性,与金属反应不生成氢气。
(3)在金属活动性顺序表中排在最前面的金属如K、 Na活泼性太强,放入酸溶液中首先跟酸发生置换反应,过M的金属会继续跟水发生剧烈的反应。
(4)铁与非氧化性酸反应时,始终生成亚铁盐 (Fe2+)。
(5)金属与酸反应后溶液的质量增大。
二、
(1)在金属活动性顺序表中,位于前面的金属可以把位于其后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。相隔越远,反应越容易发生。
(2)金属与盐溶液的反应,盐必须能溶于水,不溶性的盐与金属不反应,如AgCl难溶于水,Fe和AgCl不反应。
(3)不能用活泼的金属K,Ca,Na,与盐溶液反应,因为K,Ca,Na。会先与H2O发生置换反应生成碱和氢气。
金属与酸的反应不一定属于置换反应:
置换反应是指一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。一般情况下,较活泼的金属跟酸发生的化学反应属于置换反应。但由于浓硫酸(或硝酸)具有强氧化性,金属与浓硫酸(或硝酸)反应时,生成物相对比较复杂。这类反应不属于置换反应。
铝和锌的抗腐蚀性:
1.铝制品具有很好的抗腐蚀性,是因为铝与空气中的氧气反应表面生成一种致密的氧化铝薄膜,对铝起防护作用。
2.锌与铝的抗腐蚀性相似,也是在金属表面会生成一层致密的氧化锌保护膜。
发现相似题
与“按要求回答(1)硬水与软水相比,是因为硬水中含有较多的可溶...”考查相似的试题有:
- 下列有关硬水和软水的说法错误的是( )A.过滤不能使硬水变软水B.硬水是混合物,软水也不一定是纯净物C.用硬水洗衣服浪费...
- (7分)为了探究“水的净化”过程,某实验小组从河中取了水样,观察到:水样浑浊有异味;有固体小颗粒。现对水样进行如下处理:⑴...
- 为了了解运河治理效果,用烧杯、玻璃棒、漏斗等仪器对水样进行 (填实验操作),除去水中的不溶性杂质;用 (填物质名称)除...
- 下列说法错误的是 A.利用洗洁精的乳化作用可以洗去餐具上的油污B.明矾既能净水又能杀菌消毒C.误食重金属盐,可立即服用蛋...
- 下列说法中,正确的是[ ]A.均一、稳定的液体都是溶液B.20摄氏度时,NaCl的溶解度为36g,是指在20℃时,100g水中能溶解36gNaC...
- 甲、乙两物质的溶解度曲线如图所示。下列叙述中,正确的是[ ]A.t1℃时,甲和乙的饱和溶液的质量分数均是30%B. t2℃时,甲和乙...
- 如图中曲线a、b是物质A、B的溶解度曲线.试回答:(1)t4℃时,A、B溶解度大小的关系是:A______B.t2℃时,两种饱和溶液中A物...
- (10福建省福州15.)(5分)请根据图7中A、B两种固体物质的溶解度曲线,回答下列问题。(l)在____℃时,A、B两种物质溶解度相...
- 等质量的Zn和Fe样品分别跟足量的盐酸反应,得到等质量的氢气,可能的情况是______A.纯铁、纯锌 B.铁中混有镁、锌中混有铜C...
- 目前全球正面临着能源、环境、水资源、粮食等方面的危机.(1)目前人类通过化学反应获得的能量大多来自化石燃料.福州市民陆...