本试题 “下列每组各有三种物质,它们都能用分液漏斗分离的是( )A.苯和水,甲苯和水,已烷和水B.溴乙烷和酒精、溴苯和水、硝基苯和苯C.甘油和水、乙醛和水、乙酸...” 主要考查您对苯的同系物
苯
乙醇
萃取
分液
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 苯的同系物
- 苯
- 乙醇
- 萃取
- 分液
苯的同系物:
(1)概念苯的同系物是指苯环上的氧原子被烷基取代的产物,如甲苯(C7H8)、二甲苯(C8H10)等。苯的同系物的通式为
(2)简单苯的同系物的物理性质甲苯、二甲苯、乙苯等简单的苯的同系物,在通常状况下都是无色液体,有特殊的气味,密度小于1g· cm-3,不溶于水,易溶于有机溶剂,本身也是有机溶剂。
(3)苯的同系物的化学性质苯环和烷基的相互作用会对苯的同系物的化学性质产生一定的影响。如苯环使甲基的还原性增强,甲基使苯环上邻、对位氢原子更易被取代。
①苯的同系物的氧化反应:苯的同系物(如甲苯) 能使酸性KMnO4溶液褪色。
注意:甲苯、二甲苯等苯的同系物被酸性 KMnO4溶液氧化,被氧化的是侧链。如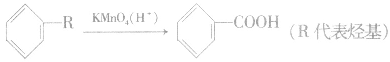
但有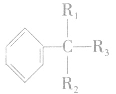 结构的苯的同系物则不能被 KMnO4(H+)溶液氧化。侧链上的氧化反应是苯环对侧链(烷基)影响的结果,说明了苯环上的烷基比烷烃性质活泼。
结构的苯的同系物则不能被 KMnO4(H+)溶液氧化。侧链上的氧化反应是苯环对侧链(烷基)影响的结果,说明了苯环上的烷基比烷烃性质活泼。
②苯的同系物的硝化反应,甲苯跟浓HNO3和浓H2SO4的混合酸可以发生反应,苯环上的氢原子被硝基取代,可以发生一硝基取代、三硝基取代等。
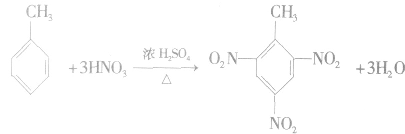
注意:甲苯比苯更易发生硝化反应,这说明受烷基的影响,苯的同系物分子里的苯环比苯分子性质更活泼,而且使苯环上烷基的邻、对位H原子更活泼。
③苯的同系物的加成反应:苯的同系物还能发生加成反应。如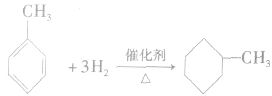
注意:发生加成反应:苯、苯的同系物比烯烃、炔烃困难。
苯的分子结构:
苯的性质:
1.物理性质苯通常是无色、带有特殊气味的液体,有毒,不溶于水,密度比水小,熔点为5.5℃,沸点为80.1℃。若用冰冷却,苯就会凝结成无色的晶体。
2.化学性质由于苯分子中的碳碳键是介于碳碳单键与碳碳双键之间的独特的键,所以它既有饱和烃的性质,又有不饱和烃的一些性质(苯的性质比不饱和烃的性质稳定)。
(1)氧化反应
①燃烧:苯易燃烧,所以在苯的生产、运输、贮存和使用过程中要注意防火。苯在空气中燃烧时有明亮火焰斤带有浓烟。因为苯分子含碳量高,没有得到充分燃烧,有碳单质产生,所以燃烧时有浓烟。
②苯与酸性高锰酸钾溶液不反应向试管中加入2mL苯,然后加入几滴酸性高锰酸钾溶液,振荡后静置,出现分层现象,上层(苯层)为无色,下层(水层)呈紫色。说明苯与酸性高锰酸钾溶液不反应。 
(2)取代反应
①卤代反应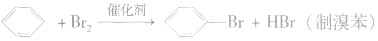
装置图如下图所示。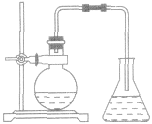
操作:把苯和少量液溴放在烧瓶里,同时加入少量铁屑作催化剂。用带导管的瓶塞塞紧瓶口,跟瓶口垂直的一段导管可以起冷凝器的作用。现象:在常温时,很快就会看到在导管口附近出现白雾(由溴遇水蒸气所形成)。反应完毕后,向锥形瓶内的液体里滴入AgNO3溶液,有浅黄色沉淀生成。把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有褐色不溶于水的液体(不溶于水的液体是溴苯,它是密度比水大的无色液体,由于溶解了溴而显示褐色)。
注意
a.苯只能与液溴发生取代,不与溴水反应,溴水中的溴只可被苯萃取。
b.反应中加入的催化剂是Fe屑,实际起催化作用的是FeBr3
c.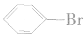 生成的是无色液体,密度大于水。
生成的是无色液体,密度大于水。
d.欲得到较纯的溴苯,可用稀NaOH溶液洗涤,以除去Br2。
②硝化反应
硝化反应是指苯分子中的氢原子被一NO2所取代的反应,也属于取代反应的范畴。 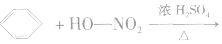

注意
a.硝酸分子中的“一NO2”原子团叫做硝基,要注意硝基(一NO2)与亚硝酸根离子(NO2-)化学式的区别。
b.硝基苯是一种带有苦杏仁味的、无色的油状液体,不溶于水,密度比水大。硝基苯有毒。
c.为便于控制温度,采用水浴加热。
(3)加成反应
苯分子中的碳碳键不是典型的碳碳双键,不容易发生加成反应(不能使溴的四氯化碳溶液褪色),但在一定条件下可与氢气发生加成反应,生成环己烷,反应的化学方程式为: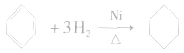
乙醇分子的组成与结构:
乙醇分子可以看成是乙烷分子中的一个氢原子被羟基(一OH)取代而形成的。乙醇分子的组成与结构见下表: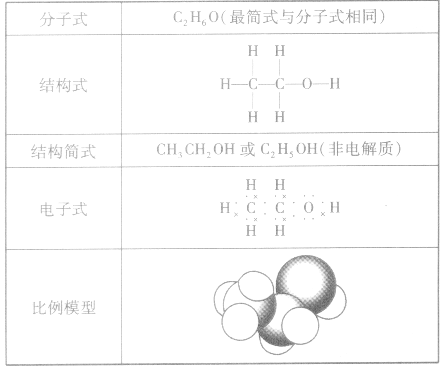
乙醇的性质:
(1)物理性质:俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。
(2)乙醇的化学性质:
①乙醇可以与金属钠反应,产生氢气,但不如水与金属钠反应剧烈。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
活泼金属(钾、钙、钠、镁、铝)可以将乙醇羟基里的氢取代出来。
②乙醇的氧化反应:
2CH3CH2OH+O2→2CH3CHO+2H2O(条件是在催化剂Cu或Ag的作用下加热)
③乙醇燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2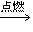 2CO2+3H2O
2CO2+3H2O
④乙醇可以和卤化氢发生取代反应,生成卤代烃和水。
C2H5OH+HBr→C2H5Br+H2O
注意:通常用溴化钠和硫酸的混合物与乙醇加热进行该反应。故常有红棕色气体产生。
⑤乙醇可以在浓硫酸和高温的催化发生脱水反应,随着温度的不同生成物也不同。
A. 消去(分子内脱水)制乙烯(170℃浓硫酸) C2H5OH→CH2=CH2↑+H2O (消去反应)
B. 缩合(分子间脱水)制乙醚(140℃ 浓硫酸) 2C2H5OH→C2H5OC2H5+H2O(取代反应)
有关醇类的反应规律:
1.消去反应的规律
总是消去和羟基所在碳原子相邻的碳原子上的氢原子,没有相邻的碳原子(如CH3OH)或相邻的碳原子上没有氢原子(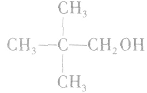 )就不能发生消去反应。能发生消去反应的醇的结构特点为:
)就不能发生消去反应。能发生消去反应的醇的结构特点为: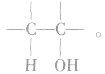
2.催化氧化反应的规律:
与羟基相连的碳原子上若有2个或3个氢原子,羟基则易被氧化为醛;若有1个氢原子,羟基则易被氧化为酮;若没有氢原子,则羟基一般不能被氧化。即
3.酯化反应的规律
醇与羧酸或无机含氧酸发生酯化反应,一般规律是“酸去羟基醇去氢”即酸脱去一OH,醇脱去一H。
例如: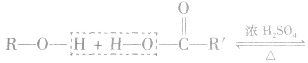

可用氧的同位素: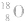 作为示踪原子来确定反应机理。如:
作为示踪原子来确定反应机理。如: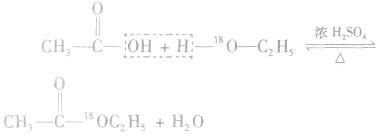
乙醇的工业制法:
(1)乙烯水化法:
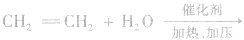
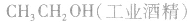
(2)发酵法:

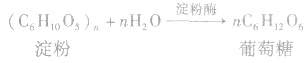
| 名称 | 用途 | 装置 | 举例 | 注意事项 |
| 萃取 | 分离两种互溶的液体 |  |
CCl4把溴水中的Br2萃取出来 |
①萃取后再进行分液操作 ②对萃取剂的要求:与原溶剂互不混溶,不反应;溶质在其中的溶解度比在原溶剂中大;溶质不与萃取剂反应 ③萃取后得到的仍是溶液,一般要通过分馏等方法进一步分离 |
分液:
| 名称 | 用途 | 装置 | 举例 | 注意事项 |
| 分液 | 分离两种不相混溶的液体(密度不同) | 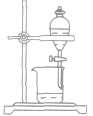 |
水、苯的分离 | 下层液体从下口放出,上层液体从上口倒出 |
与“下列每组各有三种物质,它们都能用分液漏斗分离的是( )A....”考查相似的试题有:
- 足量的NaOH溶液与0.1 mol阿斯匹林(结构简式为)反应,最多消耗NaOH的物质的量 ( )A.0.1 molB.0.2 molC.0.3 molD.0...
- 在甲苯中,加入少量酸性高锰酸钾溶液,振荡后溶液褪色,下列解释正确的是 ( ) A.甲基受苯环的影响而易被氧化B.苯环被KMnO4所氧...
- 有甲、乙、丙三种物质: 甲 乙 丙(1)关于乙下列叙述正确的是 a.1mol该有机物在加热和催化剂作用下,最多能和2molNaOH反应b...
- 下列做法中正确的是( )A.除去乙烷中少量的乙烯:与适量的氢气混合加热,把乙烯转化为乙烷B.除去苯中的少量己烯:加入浓溴...
- 古有“杜康酿酒反为醋”的传说,高粱、玉米等粮食是酿酒工业的主要原料.粮食发酵可得有机化合物A,在A分子中碳的质量分数为52....
- 下列实验能够成功的是( )A.只用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种液体B.将乙醇加热到170 ℃可制得乙烯C....
- 下列实验结论不正确的是( )实验操作现象结论A某有机物与溴的四氯化碳溶液混合溶液褪色有机物含碳碳双键B乙醇与重铬酸钾(K2...
- 利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )A.向容量瓶中转移B.制氢氧化亚铁C.碳酸氢钠受热D.萃取、分液
- 下列实验操作中正确的是[ ]A. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热B. 蒸馏操作时,应使温度计水银球靠近...
- 下例说法正确的在后面写“对”,错误的在后面写“错”(1)标准状况下任何气体的摩尔体积都是22.4L______(2)酒精作为从碘水中萃...