本试题 “化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297kJ 即H-I键的键能为297kJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297k...” 主要考查您对键能、键长、键角
共价键
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 键能、键长、键角
- 共价键
- 化学反应热的计算
共价键的键参数:
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如, 分子中:
分子中:
X原子半径: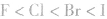
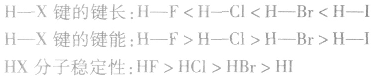
(1)键能:指气态基态原子形成1mol化学键释放的最低能量。键能越大,化学键越稳定。
(2)键长:指成键原子的核间距。键长越短,共价键越稳定。
注意:我们通常通过比较两原子的共价半径来比较共价单键键长的大小,但共价键的键长并不等于两原子的共价半径之和。
(3)键角:在多原子分子内,两个共价键之间的夹角。
键角是描述分子立体结构的重要参数。多原子分子的键角是一定的,表明共价键具有方向性。

说明:键长、键能决定共价键的强弱和分子的稳定性。原子半径越小,键长越短,键能越大,分子越稳定。例如,
 分子中:
分子中: X原子半径:
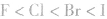
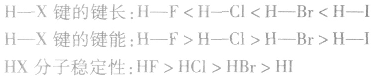
共价键:
1.本质原子之间形成共用电子对(或电子云重叠),使得电子出现在核间的概率增大。
2.特征
具有方向性与饱和性。
(1)共价键的饱和性一个原子中的一个未成对电子与另一个原子中的一个未成对电子配对成键后,一般来说就不能再与其他原子的未成对电子配对成键了,即每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,这称为共价键的饱和性。
例如,氯原子中只有一个未成对电子,所以两个氯原子之间可以形成一个共价键,结合成氯分子,表示为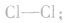 氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为
氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为 一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为
一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为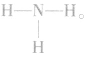
(2)共价键的方向性
共价键将尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。除s轨道是球形对称外,其他原子轨道都具有一定的空间分布。在形成共价键时,原子轨道重叠得越多,电子在核间出现的概率越大,所形成的共价键就越牢固。
例如,硫原子的价电子排布是 有两个未成对电子,如果它们分布在互相垂直的
有两个未成对电子,如果它们分布在互相垂直的 轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的
轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的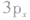 轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的
轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的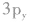 轨道上的电子配对成键。
轨道上的电子配对成键。
说明:
①共价键的饱和性决定着各种原子形成分子时相互结合的数量关系。如一个氢分子只能由两个氢原子构成,一个水分子只能由两个氢原子和一个氧原子构成。
②共价键的方向性决定着分子的空间构型。
3.分类
(1)按成键原子是否相同或共用电子对是否偏移分 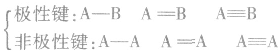
(2)按成键方式分

(3)按共用电子对数分
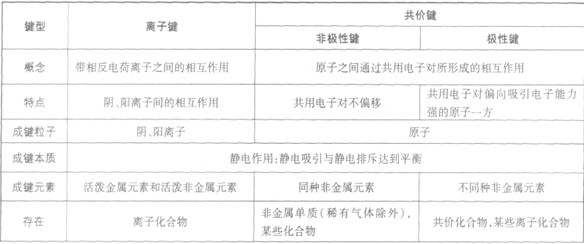
离子键和共价键:

应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
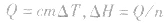
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
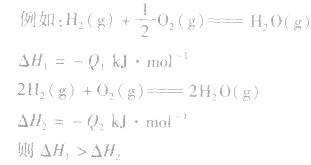
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即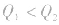 .
.
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
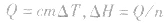
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
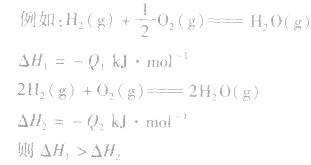
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
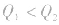 .
. 发现相似题
与“化学键的键能是指气态原子间形成1mol化学键时释放的能量。如...”考查相似的试题有:
- 在以下性质的比较中,正确的是[ ]A.微粒半径:O2--++B.单质的熔点:LiC.分子中的键角:CH4>H2O>CO2D.晶格能由大到小...
- 六氟化硫分子呈正八面体(如下图所示),在高电压下仍有良好的绝缘性,性质稳定,在电器工业方面有着广泛的用途,但逸散到空气...
- 下列说法正确的是[ ]A、已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-3mo1·L-1的AgNO3溶液和1×10-3mo1·L–1K2CrO4溶液混合...
- 从实验测得不同物质中O-O之间的键长和键能的数据:其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x...
- (1)_______和_______是衡量共价键稳定性的参数。(2)键长是形成共价键的两个原子之间的_______间距。键长越长,键能______...
- 下列各组物质的晶体中化学键类型相同,晶体类型也相同的是[ ]A.SO2和SiO2B.CO2和H2OC.NaCl和HClD.NaOH和CCl4
- 下列关于化学键的叙述中正确的是[ ]A.化学键既存在于相邻原子之间,又存在于相邻分子之间B.两个原子之间的相互作用叫化学键...
- (1)1.00L 1.00mol/L硫酸溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,写出该反应的热化学方程式______;由...
- 2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题...
- 已知1mol CO气体完全燃烧生成CO2气体放出283KJ热量;1mol H2完全燃烧生成液态水放出286KJ热量;1mol CH4气体完全燃烧生成CO2...