本试题 “下列化学实验事实及其解释都正确的是( ) A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应B....” 主要考查您对(浓、稀)硝酸
原电池原理
电解池原理
玻璃、陶瓷、水泥
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- (浓、稀)硝酸
- 原电池原理
- 电解池原理
- 玻璃、陶瓷、水泥
硝酸的分子结构:
化学式(分子式):HNO3,结构式:HO—NO2。 HNO3是由极性键形成的极性分子,故易溶于水,分子问以范德华力结合,固态时为分子晶体。
硝酸的物理性质和化学性质:
(1)物理性质:纯硝酸是无色油状液体, 开盖时有烟雾,挥发性酸[沸点低→易挥发→酸雾]
熔点:-42℃,沸点:83℃。密度:1.5 g/cm3,与水任意比互溶,98%的硝酸为发烟硝酸,69%以上的硝酸为浓硝酸。
(2)化学性质:
①具有酸的一些通性:例如: 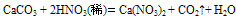 (实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
(实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
②不稳定性:HNO3见光或受热发生分解,HNO3越浓,越易分解.硝酸分解放出的NO2溶于其中而使硝酸呈黄色。有关反应的化学方程式为: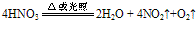
③强氧化性:不论是稀HNO3还是浓HNO3,都具有极强的氧化性,HNO3浓度越大,氧化性越强。其氧化性表现在以下几方面
A. 几乎能与所有金属(除Hg、Au外)反应。当HNO3与金属反应时,HNO3被还原的程度(即氮元素化合价降低的程度)取决于硝酸的浓度和金属单质还原性的强弱。对于同一金属单质而言,HNO3的浓度越小,HNO3被还原的程度越大,氮元素的化合价降低越多。一般反应规律为:
金属 + HNO3(浓) → 硝酸盐 + NO2↑ + H2O
金属 + HNO3(稀) → 硝酸盐 + NO↑ + H2O
较活泼的金属(如Mg、Zn等) + HNO3(极稀) → 硝酸盐 + H2O + N2O↑(或NH3等)
金属与硝酸反应的重要实例为:
①
该反应较缓慢,反应后溶液显蓝色,反应产生的无色气体遇到空气后变为红棕色(无色的NO被空气氧化为红棕色的NO2)。实验室通常用此反应制取NO气体。
②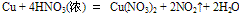
该反应较剧烈,反应过程中有红棕色气体产生。此外,随着反应的进行,硝酸的浓度渐渐变稀,反应产生的气体是NO2、NO等的混合气体。
B. 常温下,浓HNO3能将金属Fe、A1钝化,使Fe、A1的表面氧化生成一薄层致密的氧化膜。因此,可用铁或铝制容器盛放浓硝酸,但要注意密封,以防止硝酸挥发变稀后与铁、铝反应。(与浓硫酸相似)
C. 浓HNO3与浓盐酸按体积比1∶3配制而成的混合液叫王水。王水溶解金属的能力更强,能溶解金属Pt、Au。
D. 能把许多非金属单质(如C、S、P等)氧化,生成最高价含氧酸或最高价非金属氧化物。例如: 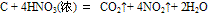
E.能氧化某些具有还原性的物质,如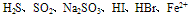 等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
(3)保存方法:硝酸易挥发,见光或受热易分解,具有强氧化性而腐蚀橡胶,因此,实验室保存硝酸时,应将硝酸盛放在带玻璃塞的棕色试剂瓶中,并贮存在黑暗且温度较低的地方。
(4)用途:硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、硝酸盐等。
三大强酸:
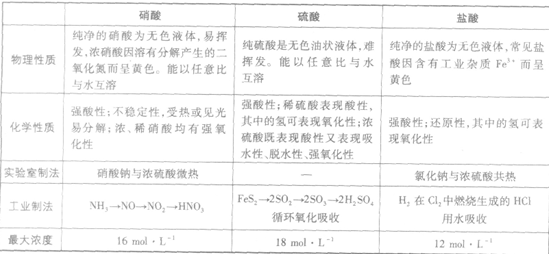
几种常见酸的比较:
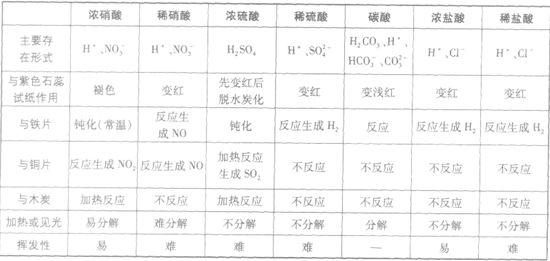
浓硝酸与稀硝酸的氧化性比较:
由铜与硝酸反应的化学方程式知,浓硝酸被还原为NO2,氮的化合价由+5→+4;而稀硝酸被还原为NO,氮的化合价由+5→+2,由此得出稀硝酸具有更强的氧化能力的结论是错误的。因为氧化剂氧化能力的强弱取决于得电子能力的强弱,而不是本身被还原的程度。实验证明,硝酸越浓,得电子的能力越强,因而其氧化能力越强。如稀硝酸能将HI氧化为I2,而浓硝酸可将HI氧化为HIO3。
硝酸在氧化还原反应中,其还原产物可能有多种价态的物质: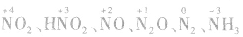 等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
浓硝酸的漂白作用:
在浓硝酸中滴入几滴紫色石蕊试液,微热,可观察到:溶液先变红后褪色,说明浓硝酸具有强氧化性,可以使某些有色物质褪色(氧化漂白)。但一般不用它作漂白剂,因为它还具有强腐蚀性。新制氯水或浓硝酸能使淀粉碘化钾试纸先变蓝后褪色,这不是因为它们的漂白性,而是因为发生了如下的化学反应: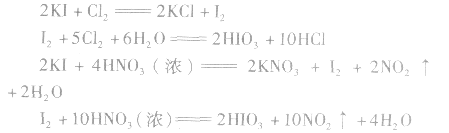
这是因为过量的氯水或硝酸又把I2氧化成了HIO3而使试纸褪色的。
另外,浓H2SO4遇湿润的蓝色石蕊试纸的现象是先变红后变黑。这是由浓H2SO4的强酸性和脱水性造成的(脱水炭化而变黑)。
1.定义:将化学能转化为电能的装置。
2.工作原理:
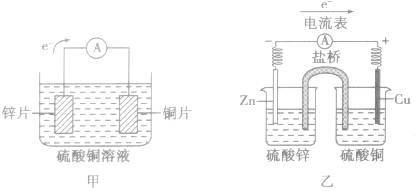
以铜-锌原电池为例

(1)装置图:
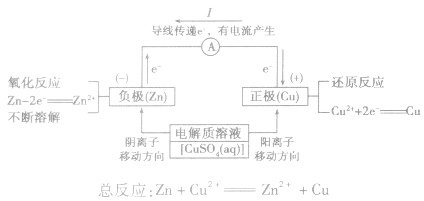
(2)原理图:
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


传统无机非金属材料:
| 硅酸盐产品 | 水泥 | 玻璃 | 陶瓷 |
| 主要设备 | 水泥回转窑 | 玻璃熔炉 | |
| 原料 | 石灰石、石膏和黏土 | 纯碱、石灰石、石英 | 黏土 |
| 反应原理 | 复杂的物理,化学变化 | Na2CO3+SiO2 Na2SiO3+CO2↑ Na2SiO3+CO2↑CaCO3+SiO2  CaSiO3+CO2↑ CaSiO3+CO2↑ |
复杂的物理,化学变化 |
| 主要成分 | 2CaO·SiO2 3CaO·SiO2 3CaO·Al2O3 |
Na2O·CaO·6SiO2 | |
| 特性 | 水硬性 | 非晶体、无固定熔点,在一定温度范围内软化可制成各种形状 | 抗氧化、抗酸碱腐蚀、耐高温、绝缘 |
| 共同特点 | ①都用含硅的物质作原料 ②反应条件都是高温 ③都发生复杂的物理、化学变化 ④冷却后都生成成分复杂的硅酸盐 | ||
几种玻璃的特性和用途:
| 种类 | 特性 | 用途 |
| 普通玻璃 | 熔点较低 | 窗玻璃、玻璃瓶等 |
| 石英玻璃 | 膨胀系数小、耐酸碱、强度大、滤光 | 化学仪器;高压水银灯、紫外灯的灯壳等 |
| 光学玻璃 | 透光性能好、有折光和色散性 | 眼镜片;照相机、显微镜、望远镜用凹凸透镜等光学仪器 |
| 玻璃纤维 | 耐踌蚀、不怕烧、不导电、不吸水、隔热、吸声、防虫蛀 | 太空飞行员的衣服等 |
| 钢化玻璃 | 耐高温、耐腐蚀、强度大、质轻、抗震裂等 | 运动器材;汽车、火车窗玻璃等 |
| 有色玻璃 | 加入金属氧化物 红色:Cu2O 蓝色:Co2O3 |
工艺品、窗玻璃等 |
无机非金属材料:
1.无机非金属材料的分类:

2.无机非金属材料的定义:
最初,无机非金属材料主要是指硅酸盐材料,所以,硅酸盐材料也称为传统无机非金属材料。随着科学和生产技术的发展,以及人们生活的需要,一些具有特殊结构、特殊功能的新材料被相继研制出来,如半导体材料、超硬耐高温材料、发光材料等,我们称这些材料为新型无机非金属材料。
与“下列化学实验事实及其解释都正确的是( ) A.过量的铜屑与稀硝...”考查相似的试题有:
- 下列各组物质反应的生成物中只有一种气体(常温常压)的是( )A.足量铜和浓硝酸反应B.碳和浓硫酸共热C.碳酸氢铵和足量氢...
- 下列说法正确的是( )A.需要加热才能发生的反应一定都是吸热反应B.任何放热反应在常温下都会发生C.在原电池中,电能转变...
- 控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成下图所示的原电池。下列判断不正确的是A.为证明反应的发生,可取甲中溶液加...
- 下列能量变化属于原电池的是( )A.电能转化成化学能B.化学能转化为电能C.化学能转化为热能D.化学能转化为光能
- 铜锌原电池(如右图)工作时,下列叙述正确的是A.正极反应为:Zn—2e-=Zn2+B.电池反应为:Zn+Cu2+=Zn2++CuC.在外电路中,电...
- 我国首创的海水电池以铝为负极,铂网为正极,海水为电解质溶液。空气中的氧气与铝反应产生电流,电池总反应为:4Al + 3O2+ 6H...
- 按如图所示装置进行下列不同的操作,其中不正确的是( )A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只...
- 1 L K2SO4和CuSO4的混合溶液中c(S)="2.0" mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体...
- 以Pt为电极,电解含有0.10mol M+和0.10mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线...
- 某普通玻璃中,Na2SiO3、CaSiO3、SiO2的物质的量之比为1:1:4,请回答下列问题:(1)该玻璃如以aNa2O·bCaO·mSiO2表示其组 成则a...