本试题 “联合国气候变化大会于2009年12月7~18目在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.(1)有效“减碳”的手段之一是节...” 主要考查您对盖斯定律
粒子浓度大小的比较
盐类水解判断溶液酸碱性或比较溶液pH值的大小
沉淀溶解平衡
燃料和能源(氢能、风能、核能、太阳能等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盖斯定律
- 粒子浓度大小的比较
- 盐类水解判断溶液酸碱性或比较溶液pH值的大小
- 沉淀溶解平衡
- 燃料和能源(氢能、风能、核能、太阳能等)
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
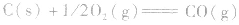 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。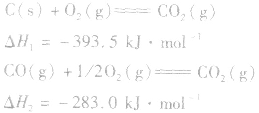
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
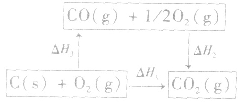
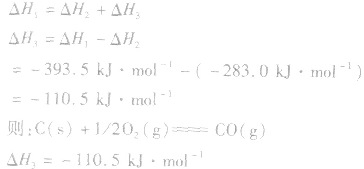
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
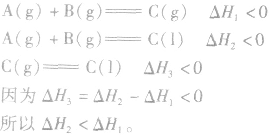
若按以下思路分析:
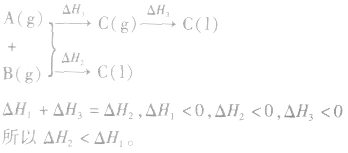
2.同一反应物状态不同时
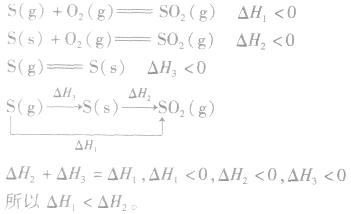
3.两个有联系的不同反应相比
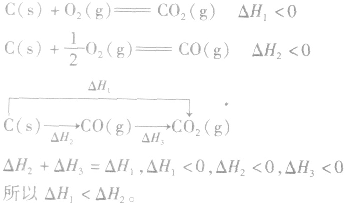
并且据此可写出下面的热化学方程式:

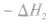
离子浓度大小比较方法:
(1)考虑水解因素:如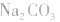 溶液
溶液 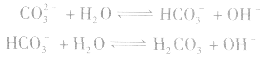
所以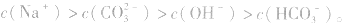
(2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的
 三种溶液中,
三种溶液中, 由大到小的顺序是c>a>b。
由大到小的顺序是c>a>b。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素。如相同浓度的 的混合液中,离子浓度顺序为:
的混合液中,离子浓度顺序为: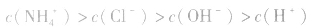
 的电离程度大于
的电离程度大于 的水解程度。
的水解程度。
盐溶液的“三大守恒”:
①电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:
推出: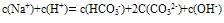
②物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nc(Na+):nc(C)=1:1,
推出: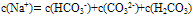
③质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系: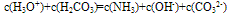
(2)粒子浓度大小比较的方法:
①单一溶液中离子浓度大小的比较
A. 一元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)
如:在CH3COONa溶液中各离子浓度大小关系: 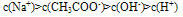
B. 二元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)> c(二级水解离子)>c(水电离出的另一离子)
如:Na2CO3溶液中离子浓度的关系: 
②比较不同电解质溶液中同一种粒子浓度的大小。应注意弱酸、弱碱电离程度的大小以及影响电离度的因素,盐类水解及水解程度对该粒子浓度的影响。
③比较经过反应化学反应后离子浓度的大小:
A. 确定电解质溶液的成分
B. 确定溶液中含哪些粒子(分子、离子),此时要考虑物质的电离和水解情况
C. 确定各种粒子的浓度或物质的量的大小
D. 根据题目要求做出判断
注:要抓住“两小”。即弱电解质电离程度小,故未电离的弱电解质分子数远多于已电离出离子数目;盐的水解程度小,故未水解的粒子数目远多于水解生成的粒子数目
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
酸式盐溶液酸碱性的判断:
酸式盐的水溶液显什么性,要看该盐的组成微粒。
1.强酸的酸式盐只电离,不水解,溶液一定显酸性。如 溶液:
溶液: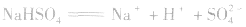
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液显碱性。例如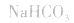 溶液中:
溶液中: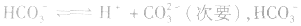
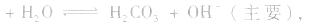
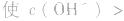
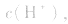 溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
(2)若电离程度大于水解程度,溶液显酸性。例如 溶液中:
溶液中: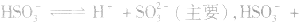
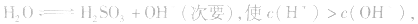 溶液显酸性
溶液显酸性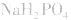 溶液亦显酸性。
溶液亦显酸性。
盐溶液蒸干后所得物质的判断:
1.考虑盐是否分解。如加热蒸干 溶液,因
溶液,因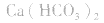 分解,所得固体应是
分解,所得固体应是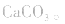
2.考虑氧化还原反应。如加热蒸干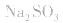 溶液,因
溶液,因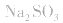 易被氧化,所得固体应是
易被氧化,所得固体应是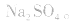
3.盐水解生成挥发性酸时,蒸干后一般得到弱碱,如蒸干 溶液,得
溶液,得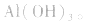 盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干
盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干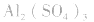 溶液,得
溶液,得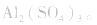
4.盐水解生成强碱时,蒸干后一般得到原物质,如蒸干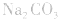 溶液,得到
溶液,得到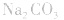 等。
等。
5.有时要多方面考虑,如加热蒸干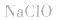 溶液时,既要考虑水解,又要考虑
溶液时,既要考虑水解,又要考虑 的分解,所得固体为
的分解,所得固体为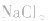
1、定义:在一定条件下,当难容电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。
例如:
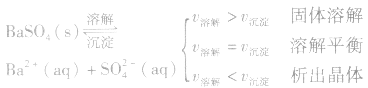
2、沉淀溶解平衡的特征:
(1)逆:沉淀溶解平衡是可逆过程。
(2)等:
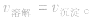
(3)动:动态平衡,溶解的速率和沉淀的速率相等且不为零。
(4)定:达到平衡时,溶液中各离子的浓度保持不变,
(5)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3、沉淀溶解平衡的影响因素
(1)内因:难溶电解质本身的性质。
(2)外因
a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但
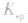 不变。
不变。 b.温度:多数难溶电解质溶于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时
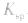 变大。
变大。 c.同离子效应:向沉淀溶解平衡体系中,加入含原体系中某离子的物质,平衡向沉淀生成的方向移动,但
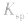 不变。
不变。 d.其他:向沉淀溶解平衡体系中,加入可与体系巾某些离子反应生成更难溶的物质或气体的物质,平衡向溶解的方向移动,
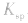 不变。
不变。沉淀溶解平衡的应用:
1.沉淀的生成
(1)意义:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法
a.调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使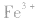 转变为
转变为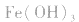 沉淀而除去。
沉淀而除去。 
b.加沉淀剂法:如以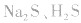 等作沉淀剂,使某些金属离子如
等作沉淀剂,使某些金属离子如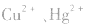 等生成极难溶的硫化物
等生成极难溶的硫化物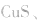
 等沉淀,也是分离、除杂常用的方法。
等沉淀,也是分离、除杂常用的方法。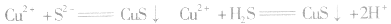
说明:化学上通常认为残留在溶液中的离子浓度小于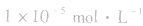 时即沉淀完全。
时即沉淀完全。
2.沉淀的溶解
(1)意义:在实际工作中,常常会遇到需要使难溶物质溶解的问题、根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去沉淀溶解平衡体系中的相应离子,使 平衡就会向沉淀溶解的方向移动,使沉淀溶解。
平衡就会向沉淀溶解的方向移动,使沉淀溶解。
(2)方法
a.生成弱电解质:加入适当的物质,使其与沉淀溶解平衡体系中的某离子反应生成弱电解质。如向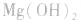 沉淀中加入
沉淀中加入 溶液,
溶液,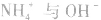 结合生成
结合生成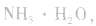 使
使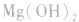 的溶解平衡向右移动。
的溶解平衡向右移动。
b.生成配合物:加入适当的物质,使其与沉淀反应生成配合物。
如:

c.氧化还原法:加入适当的物质,使其与沉淀发生氧化还原反应而使沉淀溶解。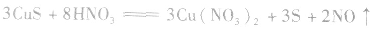
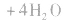
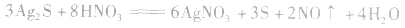
d.沉淀转化溶解法:本法是将难溶物转化为能用上述三种方法之一溶解的沉淀,然后再溶解:
如向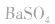 中加入饱和
中加入饱和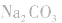 溶液使
溶液使 转化为
转化为 再将
再将 溶于盐酸。
溶于盐酸。
3.沉淀的转化
(1)实质:沉淀转化的实质就是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。 例如
(2)沉淀转化在工业上的应用在工业废水处理的过程中,用FeS等难溶物作沉淀剂除去废水中的重金属离子.
固体物质的溶解度:
绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。不同的固体物质在水中的溶解度差别很大,可将物质进行如下分类: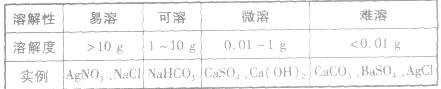
1.能源的分类:

2.各种能源的特点:
(1)传统燃料。柴草是农村使用的重要能源,但它的利用率低,且污染严重。
(2)化石燃料。这是人们目前使用的主要能源,它们的蕴藏量有限,而且不能再生,最终会枯竭,属于不可再生能源。
(3)新能源。新能源来源丰富,多数可以再生,没有污染或污染很小,所以可能成为未来的主要能源,但它们也有自己的缺点,如太阳能的能量密度低,使用成本高;氢能储仔、运输困难;风能不稳定,受地区、季节、气候的影响大。
3.我国的能源状况
(1)能源种类。我国的能源种装有化石燃料、水能和核能,其中化石燃料和水能的人均值太低,核能—一铀已探日月的储量很低,仅够4000万干瓦核电站运行 30年。
(2)我国能源的总消费量和人均消费量从改革开放以来~直到1995年逐年增加,从1995年开始有减少的趋势。
(3)我国能源利用率低,只有9%,能源节约的空间很大。
4.使用化石燃料的利弊及新能源的开发
(1)燃料充分燃烧的两个条件:
①要有足够的空气;
②燃料与空气要有足够大的接触面积。
(2)重要的化石燃料:煤、石油、天然气
(3)煤作燃料的利弊问题:
①煤是重要的化工原料;
②煤直接燃烧时产生SO2等有毒气体和烟尘,对环境造成严重污染;
③煤作为固体燃料,燃烧反应速率小,热利用率低,且运输不方便;
④可以通过清洁煤技术,如煤的液化和气化以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(4)新能源的开发:
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发新能源等;
②现在正在探索的新能源有太阳能、地热能、海洋能、生物质能、风能和氢能等。
与“联合国气候变化大会于2009年12月7~18目在哥本哈根召开.中国...”考查相似的试题有:
- 二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料(已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H...
- 下列有关各溶液的表述正确的是[ ]A.0.1 mol·L-1NH4Cl溶液中:c(NH4+)=c(Cl-)B.将稀硫酸滴入硝酸钠溶液得到的pH=5的混合溶...
- 某溶液中含有NH4+、H+、SO42-和OH-,对该溶液的描述一定正确的是( ) A.该溶液可能呈酸性,也可能呈碱性或中性 B.只能是硫...
- 下列叙述错误的是[ ]A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(H+) + c(CH3COOH) = c(CH3COO-) +2c(OH-)B...
- 在25℃时,在浓度为1mol/L的(NH4)2SO4、(NH4)c(单位为mol/L)。下列判断正确的是 A.a=b=cB.a>b>cC.a>c>bD.c>a>b
- (共8分)(1)Fe(NO3)3的水溶液呈 ___ (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): 。实验室在配制Fe(NO3)3的溶...
- A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去)...
- 已知难溶电解质在水溶液中存在溶解平衡:MmAn(s)mMn+(aq)+nAm-(aq),Ksp=[Mn+]·[Am-]n,称为溶度积。某学习小组欲探究CaSO4...
- 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据...
- 下列关于能源和作为能源使用的物质的叙述中错误的是( )A.太阳能电池利用太阳能的方式是光-电转换B.生物质能本质上是太阳...