本试题 “回答下列问题(1)画出磷原子的原子结构示意图:______.(2)写出H2S分子的电子式:______.(3)写出表示含有8个质子,10个中子的原子的化学符号:______....” 主要考查您对原子结构示意图
电子式的书写
化学键与化学反应中能量变化的关系
原电池电极反应式的书写
电解池电极反应式的书写
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子结构示意图
- 电子式的书写
- 化学键与化学反应中能量变化的关系
- 原电池电极反应式的书写
- 电解池电极反应式的书写
- 化学反应热的计算
定义:
圆圈和圆圈内的数字分别表示原子核和核内的质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
表示原子结构的常用图示:
1.原子符号:
2.核外电子分层排布示意图:
3.原子结构示意图:
相对原子质量及近似相对原子质量:
1.几个概念的辨析
| 原子的真实质量 | 原子的真实质量也称绝对质量,是通过精密的实验测得的,原子的真实质量很小,使用极不方便,所以科学上,一般不直接使用原子的真实质量,而使用原子的相对质量—— 相对原子质量 |
| 核素的相对原子质量 | 核素的相对原子质量是指一个核素原子的质量与一个碳-12原子质量的l/12的比值 |
| 元素的相对原子质量 | 元素的相对原子质量是指某元素各种核素的相对原子质量与各核素原子所占的原子个数百分比(丰度)的乘积之和,也就是元素周期表中所给的相对原子质量的数值。一般情况下元素的相对原子质量不为整数 |
| 原子的质量数 | 原子的质量数是指某元素的一种核素原子的核中所含质子数和中子数之和,在实际使用中常代替相对原子质量,所以也叫做近似相对原子质量。需要注意的是元素无质量数 |
2.近似相对原子质量
1.核素的近似相对原子质量,就是核素的质量数。
2.元素的近似相对原子质量,就是按照该元素各种核素的质量数和各种核素原子所占的原子个数百分比算出的平均值。例如,氯元素的近似相对原子质量为:
定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、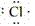
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、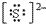
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: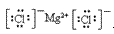 、
、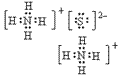
(5)共价化合物的电子式:画出离子最外层电子数: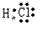 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: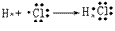
氯化镁的形成过程: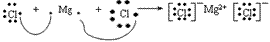
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: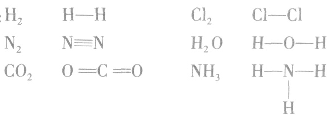
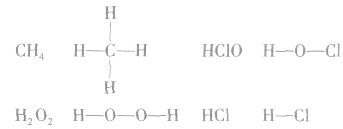
书写电子式的常见错误:
1.漏写未参与成键的电子,如: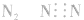
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: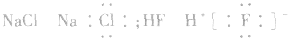
3.书写不规范,错写共用电子对如:N2的电子式为: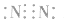 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: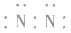 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: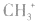 的电子式为
的电子式为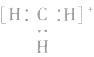 ,而非
,而非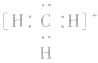 , 因
, 因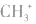 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: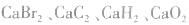 中
中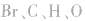 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: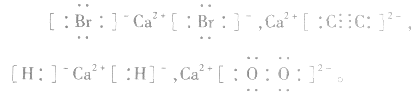
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若 或
或 ,反应为吸热反应。
,反应为吸热反应。(1)以铜锌原电池为例:
负极(Zn):Zn-2e-=Zn2+
正极(Cu):2H++2e-=H2↑
(2)正负极反应式的书写技巧:
①先确定原电池的正负极,在两极的反应物上标出相同数目的电子得失。
②根据物质放电后生成物的组成和电解质溶液中存在的离子,找到电极反应中还需要的其它离子。此时要注意溶液的酸碱性,从而判断应该是H+、OH-还是H2O参与了反应。因Zn反应后生成了Zn(OH)2,而KOH为电解质,可知负极上OH-参与了反应。MnO2生成了MnO(OH),即增加了氢元素,可知正极上有水参与了反应。
③根据电子守恒和电荷守恒写出电极反应式,即要注意配平和物质的正确书写形式,应按照离子方程式的书写要求进行。②中反应的电极反应式为:
负极:Zn+2OH--2e-=Zn(OH)2 正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
(若只要求写正极的反应式,也可以写成MnO2+H2O+e-=MnO(OH)+OH-)
原电池总反应式的书写:将正负电极反应相加,即为原电池总反应式。
原电池正、负极的判断方法:
原电池有两个电极,一个是正极,一个是负极,判断正极和负极的方法有以下几种。
1.由组成原电池的两极材料判断一般相对较活泼的金属为负极,相对不活泼的金属或能导电的非金属为正极。
2.根据电流方向或电子流动方向判断在外电路,电流由正檄流向负极;电子由负极流向正极
3.根据原电池里电解质溶液中离子的定向移动方向判断在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
4.根据原电池两极发生的变化来判断原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
5.X极增重或减轻工作后,X极质量增加,说明X极有物质析出,X 极为正极:反之,X极质量减少,说明X极金属溶解,X 极为负极
6.X极有气泡冒出工作后,x极上有气泡冒出,一般是发生了析出H,的电极反应,说明x极为正极。
7.X极附近pH的变化析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而工作后,X极附近pH增大了,说明X极为正极。
8.特例在判断金属活泼性的规律中,有一条为“当两种金属构成原电池时,活泼金属作负极,不活泼金属作正极”,但这条规律也有例外情况,如Mg和Al为原电池的两极,KOH为电解质溶液时,虽然Mg比Al活泼,但因Mg不和KOH反应,所以Mg作原电池的正极等。
1.根据装置书写电极反应式
(1)根据电源确定阴、阳两极→确定阳极是否是活性电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
(2)在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
2.由氧化还原反应方程式书写电极反应式
(1)找出发生氧化反应和还原反应的物质→确定两极名称和生成物→利用电子守恒分别写出两极反应式。
(2)若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式,即得另一电极反应式。
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
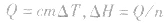
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
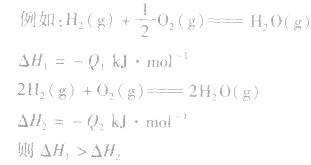
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
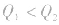 .
.与“回答下列问题(1)画出磷原子的原子结构示意图:______.(2...”考查相似的试题有:
- 在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY,X、Y均为元素周期表前20号元素,其阳离子...
- X、Y、Z是主族的三种非金属元素,它们在周期表中的位置如图所示。试回答(1)X元素单质的化学式是________。(2)Y元素的原子结构...
- 下列粒子的结构示意图中,表示铝原子的是[ ]A.B.C.D.
- A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍...
- 下列反应中,生成物的总能量大于反应物总能量的是( )A.氢气在氧气中燃烧B.铁丝在氧气中燃烧C.硫在氧气中燃烧D.焦炭在高...
- 已知在101KPa,298K条件下,2 mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )A.H2O(g)= H2(g)+ 1/...
- 下列各分子中,所有原子都满足最外层为8电子结构的是A.H2OB.NH3C.Cl2D.BCl3
- 下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法不正确的是A.放电时正极反应为...
- 用两支惰性电极插入250mlCuSO4溶液中,通电电解。当电解液的pH从6.0变为2.0时(电解时阴极没有氢气放出,且电解液在前后体积...
- 已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H1=―Q1KJ/mol2H2(g)+O2(g)==2H2O(g) △H2= ―Q2KJ/mol2H2(g)+O2(g)==2H2O(1) △H3= ―Q3KJ...