本试题 “下列叙述正确的是( )A.168O2和188O2互为同位素,性质相似B.常温下,H+、NO3-、Fe2+可以大量共存C.最外层有2个电子的原子都是金属原子D.C(石墨)=C(金...” 主要考查您对离子共存
电子排布式
原子核外电子的排布
同位素
吸热反应、放热反应
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子共存
- 电子排布式
- 原子核外电子的排布
- 同位素
- 吸热反应、放热反应
所谓离子共存实质上就是看离子间是否发生反应。若离子在溶液中发生反应,就不能共存。
因能发生氧化还原反应而不共存的离子有:
(注:“√”表示能发生反应,“×”表示不能发生反应)
|
|
S2- |
SO32- |
I- |
Fe2+ |
Br- |
Cl-(H+) |
|
MnO4- |
√ |
√ |
√ |
√ |
√ |
√ |
|
ClO- |
√ |
√ |
√ |
√ |
√ |
√ |
|
NO3-(H+) |
√ |
√ |
√ |
√ |
√ |
× |
|
Fe3+ |
√ |
√ |
√ |
× |
× |
× |
因能发生复分解反应而不共存的离子有:
- 离子间相互结合生成难溶物或微溶物
Ba2+、Ca2+ CO32-、SO32-、SO42- Ag+ CO32-、SO32-、Cl- - 离子间相互结合生成气体或挥发性物质
H+ CO32-、HCO3-、SO32-、HSO3-、S2-、HS- OH- NH4+ - 离子间相互结合生成弱电解质
H+ CO32-、SO32-、S2-、CH3COO-、F- 弱酸 OH- NH4+、Al3+、Fe3+、Cu2+、Mg2+ 弱碱 H+ 水
因能发生双水解的离子有:
| Al3+ | CO32-、HCO3-、SO32-、HSO3-、S2-、HS-、AlO2-、ClO- |
| Fe3+ | CO32-、HCO3-、AlO2-、ClO- |
| NH4+ | SiO32-、AlO2- |
因发生络合反应而不共存的离子有:
| Fe3+ | SCN- |
| Ag+、Cu2+ | NH3·H2O |
判断离子是否共存的几种情况:
(1)发生复分解反应,离子不能大量共存。
①有气体产生 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成 如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成 如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存
①具有较强还原性的离子不能与具有较强氧化性的离子大量共存 如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存 如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O不能共存 ;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
(2)溶液的颜色:有色离子MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)、Fe(SCN)2+(红)、Fe(SCN)63-(血红)。
(3)要求“大量共存”还是“不能大量共存”。
电子排布式:
①简化电子排布式
为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的冗素符号外加方括号表示,即为简化电子排布式,如K 的简化电子排布式为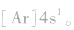
②特殊电子排布式
有个别元素的基态原子的电子排布对于构造原理有1个电子的反常。因为能量相同的原子轨道在全充满( )、半充满(
)、半充满(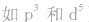 )和全空(
)和全空(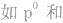
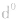 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。 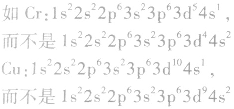
(2)电子排布图:用方框表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。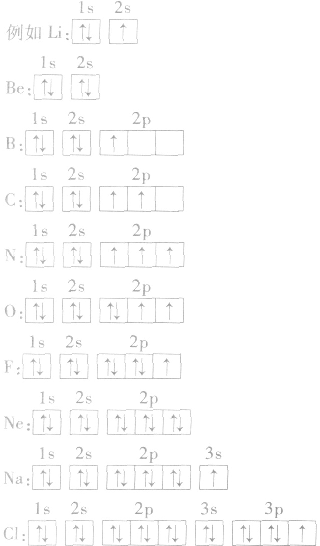
构造原理:
多电子原子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。绝大多数元素的原子核外电子的排布遵循下图所示的排布顺序,这种排布顺序被称为构造原理。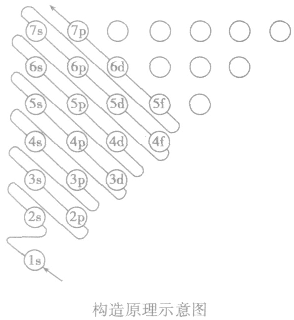
点拨:构造原理中的排布顺序,其实质是各能级的能量高低顺序,可由下列公式得出ns<(n一2)f< (n一1)d<np(n表示能层序数)。常用的重要的能级交错顺序有: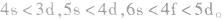
核外电子排布式一构造原理的应用:
根据构造原理,按照能级顺序,用能级符号右上角的数字表示该能级上电子数的式子,叫做电子排布式。例如,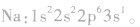
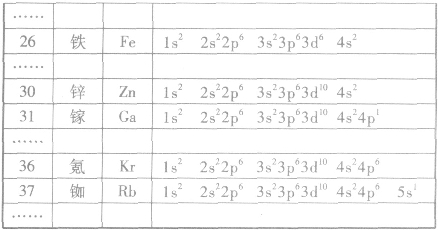
原子核外电子的排布:
在多电子原子中,由于各电子所具有的能量不同,因而分布在离核远近不同的区域内做高速运动。能量低的电子在离核近的区域内运动,能量高的电子在离核较远的区域内运动。
电子层:
电子层在含有多个电子的原子里,电子分别存能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5.6,7或K、L、 M、N、O、P、Q来表示从内到外的电子层 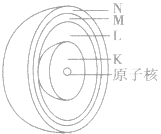

原子结构与元素的性质:
原子的核外电子排布对元素的化学性质有着非常重要的影响。元素的化学性质主要取决于原子的核外最外层电子数。
1.元素的金属性、非金属性(得失电子能力)与最外层电子数的关系
(1)稀有气体元素原子最外层电子数为8(He为 2),已达稳定结构,既不易失电子也小易得电子,所以化学性质不活泼。
(2)金属元素原子最外层电子数一般小于4,较易失去电子而达到稳定结构,其单质表现还原性。
(3)非金属元素原子最外层电子数一般大于或等于4,较易获得电子而达到稳定结构,其单质多表现氧化性。
2.元素的化合价与原子最外层电子数的关系
元素显正价还是显负价及其数值大小与原子的最外层电子数密切相关。其一般规律可归纳如下表: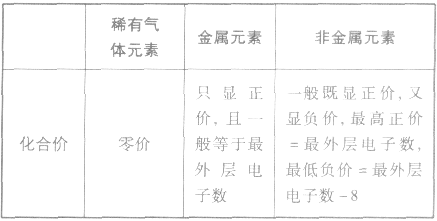
核外电子排布的一般规律:
(1)原子核外各电子层最多容纳2n2个电子.
(2)原子最外层电子数目不超过8个(K层为最外层时不超过2个)。
(3)次外层电子数目不超过18个(K层为次外层时不超过2个,L层为次外层时不超过8个)。倒数第三层电子数目不超过32个。
(4)核外电子分层排布,电子总是优先排布在能量最低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层里,即最先排K层,当K层排满后,冉排L层等。原子核外电子排布不是孤立的,而是相互联系的。层数相同而位置不同的电子层中最多容纳的电子数小一定相同,如N层为最外层时,最多只能排8个电子;N层为次外层时,最多只能排18个电子而不是32个电子(2×42=32)。
定义:
质子数相同而中子数不同的原子互称为同位素(即同一元素的不同核素互称为同位素)。元素符号表示不同,如 ;电子结构相同,原子核结构不同;物理性质不同,化学性质相同。
;电子结构相同,原子核结构不同;物理性质不同,化学性质相同。
同位素的应用:
(1)同位素在医学领域中的应用最为广泛,主要用于显像、诊断和治疗,还用于医疗用品消毒、药物作用机理研究和生理医学研究等。
(2)同位素辐射育种技术为农业提供了改进农产品质量、增加产量的新技术;利用同位素示踪技术,可检测并确定植物的最佳肥料吸入量和农药吸入量。
(3)14C纪年测定法与其他放射性同位素测定法已成为地质学、考古学、人类学、地球科学等领域广泛采用的一种准确的断代方法。
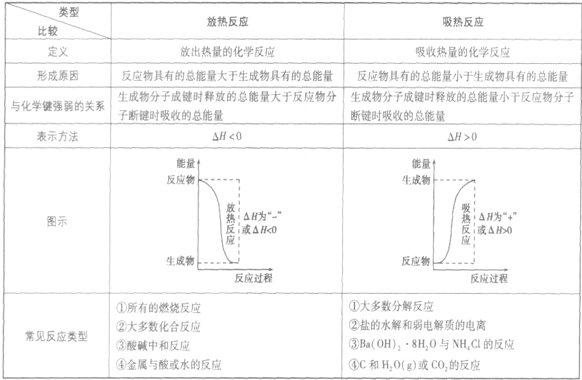
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
与“下列叙述正确的是( )A.168O2和188O2互为同位素,性质相似B...”考查相似的试题有:
- 下列各组微粒按氧化性由弱到强,半径由大到小的顺序排列的是 A.O、Cl、S、PB.K+、Mg2+、Al3+、H+C.Ca2+、Mg2+、Al3+、K+D...
- 在无色透明溶液中,一定能大量共存的离子组是( )A.Na+、Mg2+、OH-B.K+、AlO2-、OH-C.Fe3+、H+、I-D.K+、OH-、NH4+
- 取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为( )A.0.01mol·L-1B.0.017mol·L-...
- 下列有关Fe2(SO4)3溶液的叙述正确的是A.该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存B.和KI溶液反应的离子方程式:Fe3+...
- 在下列各组溶液中,离子一定能大量共存的是( )A.无色透明溶液中:HCO3-、Na+、Cl-、OH-B.含有0.1mol•L-1Fe3+的溶液中:K+...
- 下列判断错误的是:( )A.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHS04溶液混合,生成白色沉淀:Ba2++SO42‾+H++OH‾ =BaSO4...
- 醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是A.醋酸溶液中:c(H+)>c(CH3COO-)>c(OH-)B.NaHCO3溶液中:c(H+)+c(H...
- 常温下,下列各组离子在指定溶液中一定能大量共存的是A.使石蕊试液变红的溶液:Na+、K+、Cl-、CO32-B.1.0mol·L-1的HNO3溶...
- 科学家已成功合成了少量N4,有关N4的说法正确的是[ ]A.N4的摩尔质量是56gB.N4是N2的同位素C.相同质量的N4和N2所含电子个数...
- 下列叙述正确的是[ ]A.O原子核内有9个质子B.H原子核内有1个中子C.O2和O3互为同位素D.通常情况下,He等稀有气体化学性质都...