本试题 “25℃时,KW=1.0×10-14,100℃,KW=1.0×10-12,这说明( )A.100℃时水的电离程度较小B.100℃时水的酸性增强C.KW与温度无直接关系D.水的电离是一个吸热过程” 主要考查您对弱电解质的电离
水的离子积常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质的电离
- 水的离子积常数
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: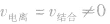 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
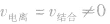 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
水的电离:
水是一种极弱的电解质,它能微弱地电离:
实验测得:25℃时,1L纯水中只有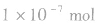 的水分子发生电离,故25℃时纯水中
的水分子发生电离,故25℃时纯水中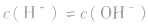

水的离子积:
在一定温度下,水电离出的c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号 表示,即
表示,即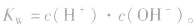
(1)在一定温度下,水的离子积都是一个常数,在25℃时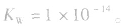
(2)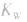 随温度的变化而变化,温度升高,
随温度的变化而变化,温度升高,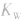 增大。
增大。
(3)水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有 存在。在酸性或碱性的稀溶液中,当温度为25℃时,
存在。在酸性或碱性的稀溶液中,当温度为25℃时,
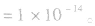
(4)在酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)总相等.即 如25℃时
如25℃时 或NaOH溶液中,
或NaOH溶液中,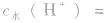
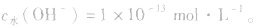
溶液中c(H+)或c(OH-)的计算:
常温下,稀溶液中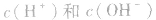 的乘积总是
的乘积总是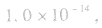 知道
知道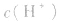 就可以计算出
就可以计算出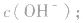 反之亦然
反之亦然
1.酸溶液
当在水中加入酸后,将使水的电离平衡向左移动 (抑制水的电离)。在酸的水溶液中,H+主要由酸电离产生,即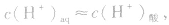 而OH-是由水电离产生的:
而OH-是由水电离产生的: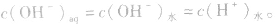
2.碱溶液
同理,在碱的水溶液中,OH-主要由碱电离产生,即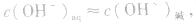 而H+是由水电离产生的:
而H+是由水电离产生的: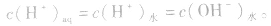
3.盐溶液
在盐的水溶液中,H+和OH-全部来自水的电离,且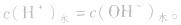
(1)若单一水解的盐的水溶液呈酸性,c(H+)> c(OH-),即弱碱阳离子水解


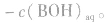
(2)若单一水解的盐的水溶液呈碱性,c(OH一)> c(H+),即弱酸阴离子水解
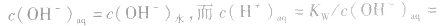
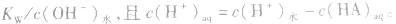
说明:由以上分析可以看出,在常温下(25℃):
酸(或碱)的溶液中,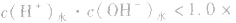
 发生水解的盐溶液中
发生水解的盐溶液中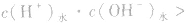
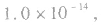 但
但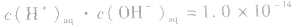 总成立。
总成立。
发现相似题
与“25℃时,KW=1.0×10-14,100℃,KW=1.0×10-12,这说明( )A.10...”考查相似的试题有:
- 浓度均为0.1mol/L的8种溶液① HNO3② H2SO4③ CH3COOH ④ Ba(OH)2⑤ NaOH ⑥ CH3COONa⑦ KCl ⑧ NH4Cl,溶液PH由大到小的顺序是_____...
- 1mL pH值相同的醋酸和盐酸,分别用蒸馏水稀释到100mL,稀释后两溶液的pH 分别为m和n( )A.m>nB.m=nC.m<nD.不能确定
- 下列事实能说明醋酸是弱酸的是 ①下当温度低于16.6℃时醋酸可凝结成冰一样晶体 ②0.1 mol/L的醋酸钠溶液的pH约为9 ③等体积等物质...
- 类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )已知类推A将Fe加入到CuSO4溶液中Fe+Cu2+=Cu...
- (1)25℃时, 0.05mol/LH2SO4溶液的PH=________;0.05mol/LBa(OH)2溶液PH= ;(2)已知100℃时,KW=1×10-12在该温度下,将100ml0.00...
- 常温下,某溶液中由水电离的c(H+) = 1×10-13mol·L-1,该溶液可能是①氯化氢水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水...
- 根据下表数据,比较在相同温度下,下列三种酸的相对强弱,正确的是:酸HXHY HZ浓度mol•L-10.10.5111电离度a%0.30.150.10.31.0...
- 把1mL0.1mol/L的H2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于( )A.1×10mol/LB.1×10mol/LC.1×10m...
- 25℃时,在溶液中逐滴加入醋酸溶液,pH的变化曲线如右图所示,有关粒子浓度关系的比较中,不正确的是
- 某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶...