本试题 “80℃时,某物质在2L的容器中发生化学反应,隔一段时间对该容器内的物质进行分析,得到如表所示数据。则下列说法正确的是[ ]A.该反应的化学方程式为2NO2N2O4B...” 主要考查您对达到化学平衡的标志
化学反应速率的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 达到化学平衡的标志
- 化学反应速率的计算
化学平衡移动的含义:
1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,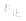 >
>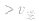 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;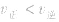 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。
化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等: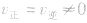 。
。
(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使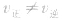 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
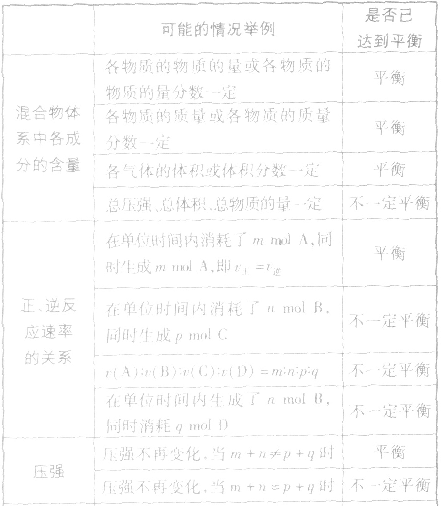
化学平衡状态的判断:
1.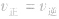 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。
2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
3.反应类型分析对于密闭容器中的反应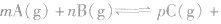 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,
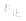 >
>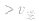 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;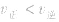 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到
 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。 化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等:
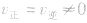 。
。(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使
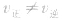 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。化学平衡状态的判断:
1.
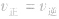 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。 2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
3.反应类型分析对于密闭容器中的反应
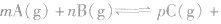 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

化学反应速率的求算:
首先要熟练掌握化学反应速率的含义,明确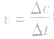 中各个量的含义和单位,如:以具体某一种物质 B表示的化学反应速率为
中各个量的含义和单位,如:以具体某一种物质 B表示的化学反应速率为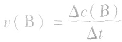 。△c的单位一般用mol/L表示,而△t的单位一般用s(秒)、min (分钟)、h(小时)等表示,所以v的单位可以是
。△c的单位一般用mol/L表示,而△t的单位一般用s(秒)、min (分钟)、h(小时)等表示,所以v的单位可以是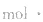

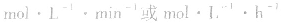 等。对于反应
等。对于反应 ,有
,有 ,利用这一关系,可以很方便地求算出不同物质表示的v的数值:
,利用这一关系,可以很方便地求算出不同物质表示的v的数值:
化学反应速率图像及其应用:
1.物质的量(或浓度)一时间图像及应用此类图像能说明反应体系各组分(或某一组分)在反应过程中的浓度变化情况。如A(g) +B(g)
 3C(g)的反应情况如图所示,
3C(g)的反应情况如图所示,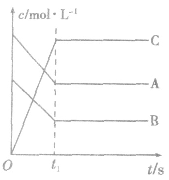
要注意此类图像各曲线的折点(达平衡)时刻相同,各物质浓度变化符合化学方程式中的计量数关系。例如:某温度时,在恒容(VL)容器中,X、Y、z三种物质的物质的量随时间的变化曲线如下图所示。
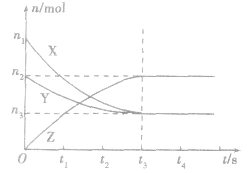
根据图像可进行如下计算:
(1)计算某物质在O一t3刻的平均反应速率、转化率,如
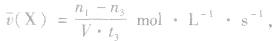 Y的转化率为
Y的转化率为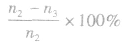 .
.(2)确定化学方程式中各物质的化学计量数之比如X、Y、z三种物质的化学计量数之比为: (n1一n3):(n2一n3):n2。
2.全程速率一时间图像如Zn与足量盐酸的反应,反应速率随时间的变化出现的情况,如图所示,

解释原因:AB段(v增大),因反应为放热反应,随反应的进行,温度升高,导致反应速率增大;BC段(v减小),则主要因为随反应的进行,溶液中 c(H+)减小,导致反应速率减小。故分析时要抓住各阶段的主要矛盾,认真分析。
3.速率一温度(压强)图像这类图像有两种情况:一是不隐含时间变化的速率一温度(压强)图,二是隐含时间变化的速率一温度 (压强)图。以
 ,△H< 0为例,V一T(P)图像如下:
,△H< 0为例,V一T(P)图像如下: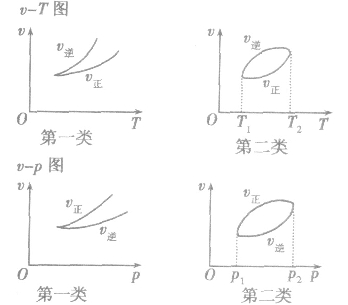
发现相似题
与“80℃时,某物质在2L的容器中发生化学反应,隔一段时间对该容器...”考查相似的试题有:
- 在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:时间/s浓度mol...
- 图中表示外界条件(T、p)的变化对下列反应的影响:L(s)+G(g)2R(g)△H>0,y 轴表示的是A.平衡时,混合气中R的百分含...
- 在2L密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:2X(g)+ 2Y(g)Z(g)+2 W(g)△H
- 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g),ΔH
- X,Y,Z三种气体,把a molX和b molY充入一密闭容器中,发生反应:X+2Y2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)...
- 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g);ΔH
- 在一固定容积的密闭容器中充入3mol A和1mol B,发生反应:3A(g)+B(g)xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和...
- 在一定温度下,向 密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)2Z(g),此反应达到限度的标志是[ ]A. 容器...
- 对于在恒容、恒温密闭容器中进行的反应H2(g)+I2(g)2HI(g),能说明其达到化学平衡状态的是( )A.容器中气体压强不变B...
- 在一定温度下,可逆反应X(g)+3Y(g)═2Z(g)达到平衡的标志是( )A.Z生成的速率与X消耗的速率相等B.单位时间生成amolX...