本试题 “下列叙述正确的是( )A.金属与盐溶液的反应都是置换反应B.阴离子都只有还原性C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物D.固体物质中可能...” 主要考查您对氧化剂、还原剂
物质的简单分类
构成物质的粒子—分子、原子、离子
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 物质的简单分类
- 构成物质的粒子—分子、原子、离子
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 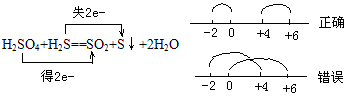
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质 注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质
混合物没有固定的组成,一般没有固定的熔沸点
常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分
注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质
注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质
(1)金属单质:如Fe、Al、Cu等
(2)非金属单质:如Cl2、O2、S等
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物
①酸:电离理论认为电解质电离出阳离子全部是H+的化合物
常见的强酸:HClO4 H2SO4 HCl HNO3等
常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等
②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物
常见强碱:NaOH KOH Ba(OH)2 Ca(OH)2等
常见弱碱:NH3·H2O Al(OH)3 Fe(OH)3等
③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐
a正盐:Na2SO4 Na2CO3 (NH4)2SO4 等
b酸式盐:NaHCO3 NaHSO4 NaH2PO4 Na2HPO4等
c碱式盐:Cu(OH)2CO3 Mg(OH)2CO3等
d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等
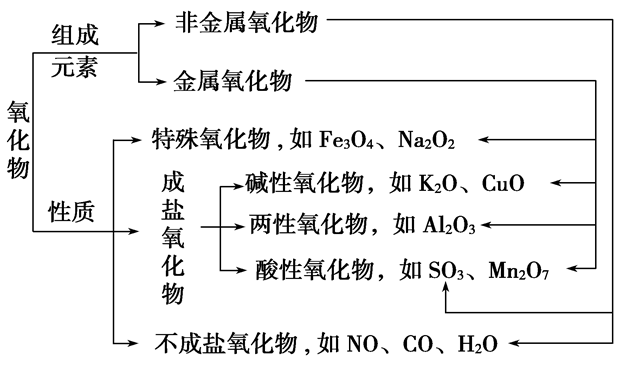
(6)氧化物:由两种元素组成,其中一种元素是氧的化合物
①按组成分:
金属氧化物:Na2O Al2O3 Fe3O4等
非金属氧化物:NO2 SO2 CO2等
②按性质分:
不成盐氧化物:CO NO等
酸性氧化物:CO2 SO2等
碱性氧化物:Na2O CuO等
两性氧化物:Al2O3 ZnO等
过氧化物:Na2O2 H2O2等
超氧化物:KO2等
特殊例子提醒:
(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。
(5)与水反应生成酸的氧化物不一定是酸性氧化物(如NO2);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2)。
无机物分类:

氧化物的分类:
构成物质的微粒:
构成物质的粒子有分子、原子、离子
分子:能够独立存在并保持物质化学性质的一种微粒。
原子:化学变化中的最小粒子。
离子:带电荷的原子或原子团。
原子的构成:
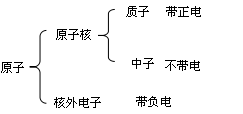
(1)在原子中核电荷数=质子数=核外电子数决定元素种类质子数(核电荷数)
(2)原子的质量主要集中在原子核上
(3)三决定:质子数决定元素种类
最外层电子数决定化学性质
原子核决定原子的质量
(4)相对原子质量≈质子数+中子数
说明:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2);最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)
原子、分子、离子的区别与联系:
区别:
离子是原子或原子团由于得失电子而形成的带电微粒。
原子是化学变化中的最小微粒。
分子是物质中保持原物质的一切化学性质、能够独立存在的最小微粒。
联系:
分子是由原子组成的。在化学变化中,分子可再分,原子不可再分。分子是独立存在而保持物质化学性质的最小粒子。
原子、分子、离子的表示方法:
原子通常用 表示,分子用化学式表示,离子用
表示,分子用化学式表示,离子用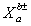 表示。
表示。
与“下列叙述正确的是( )A.金属与盐溶液的反应都是置换反应B....”考查相似的试题有:
- ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2S...
- Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O32-和Cl2反应的产物之一为SO42-。下列说法中,不正确...
- 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )。选项AB...
- 将下列物质分类,并用序号填空:①CO2②空气 ③Al ④CuO ⑤HCl ⑥碘酒 ⑦NaOH ⑧纯碱 ⑨CuSO4•5H2O ⑩酒精其中,属于混合物的是______;...
- 以下能级符号正确的是:( )A.1pB. 2dC. 3fD.4s
- 若aB2-与bAn+两种离子核外电子层结构相同,则a等于A.b+n-2B.b+n+2C.b-n-2D.b-n+2
- 下列各组无机酸的酸性强弱比较正确的是A.HClO>HClO2>HClO3>HClO4B.HF
- (8分)现有A、B、C三种元素,已知B原子序数大于A,A与B的质子数之和为27,质子数之差为5。0.9 g C单质与足量盐酸作用放出标准...
- A、B、C是元素周期表中相邻的三种元素,其中A、B同周期,B、C同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为...
- 下列各组粒子,核外电子总数和质子总数均相同的是A.S2-和HS-B.H3O+和OH-C.Na+和NH4+D.K+和Ne