本试题 “将锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池(如图所示)。下列叙述不正确的是[ ]A.铜片质量不变B.锌片发生氧化反应C.该装置将化学能转变为电能D...” 主要考查您对原电池原理
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理
原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:
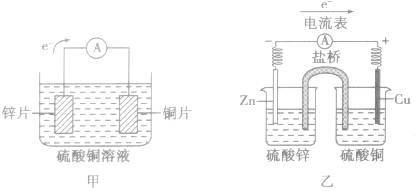
(2)原理图:
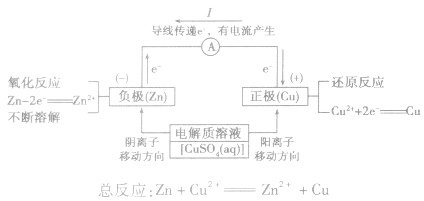
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
发现相似题
与“将锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池(如图...”考查相似的试题有:
- 如图甲、乙是电化学实验装置.(1)若甲、乙两烧杯中均盛有NaCl溶液.①甲中石墨棒上的电极反应式为______;②乙中总反应的离子...
- X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y:X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电...
- 磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下下列说法不正确的是[ ]A.在改质器中主要发生的反应为CxHy...
- 关于原电池的说法,正确的是( )A.在正极上发生氧化反应B.某电极上有氢气产生,则此电极为正极C.在外电路上电子流出的为...
- 如图甲把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。某实验兴趣小组做完实验后,在读书卡上的记录如图乙所示,则卡片...
- Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是A.Mg电极...
- 在理论上不能用于设计原电池的化学反应是 A.NaCl(aq)+ AgNO3(aq)= AgCl(s)+ NaNO3(aq )△H<0B.2CH3OH (l) +3O2(...
- 下列有关判断正确的是( ) A.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ B.由Mg、Al、NaOH溶液组成原电...
- 下列关于原电池的叙述中正确的是( )A.正极和负极必须是两种不同的金属B.原电池是把化学能转化成电能的装置C.原电池工作...
- 化学与生活、社会密切相关.下列说法正确的是( )A.红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐B.氢氧燃...