本试题 “下表是某地市场上销售的一种“加碘食盐”包装袋上的部分文字说明.配料氯化钠、碘酸钾含碘量20~30mg/1Kg保质期18个月食用方法勿长时间炖炒贮藏指南避热、避光...” 主要考查您对氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的计算
氧化还原反应的计算:
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
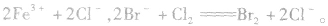 。
。
发现相似题
与“下表是某地市场上销售的一种“加碘食盐”包装袋上的部分文字说...”考查相似的试题有:
- 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性为氰化物的千分之一),氰酸盐进一步被...
- KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:( )KClO3+( )HCl(浓)( )KCl+( )ClO2↑+( )Cl2↑...
- 已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O IO3-→I2MnO4-→Mn2+HNO2→NO 如果分别用等物质的...
- a mol FeS 与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H...
- 硫代硫酸钠可用做脱氯剂,已知25.0 mL 0.10 mol·L-1Na2S2O3溶液恰好把标准状况下112 mL Cl2完全转化为Cl-,则S2O32-将转化...
- 把氯气和氮气混合气1.12L(90%Cl2和10%N2)通过浓氨水,实验测得逸出的气体(除NH3)体积为0.672L(50%Cl2和50%N2),问反应...
- “绿色试剂”双氧水可作为采矿业废液的消 毒剂,可消除采矿业废液中的氰化物(如KCN),化学方程式为:KCN +H2O2+H2O=A+NH3↑。(...
- 500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6.0mol/L.用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22.4L气体...
- 已知KH和H2O反应生成H2和KOH,反应中1 mol KH[ ]A.失去1 mol e-B.得到1 mol e- C.失去2 mol e-D.没有电子得失
- 将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaO...