本试题 “化学中常借助图像来表示某种变化过程,下列关于4个图像的说法正确的是[ ]A.图①可表示t℃时,冰醋酸稀释过程中溶液导电性的变化B.图②可表示向一定量盐酸中滴...” 主要考查您对离子反应
溶解度
导电性(单质、溶液、熔融状态导电)
溶液的酸碱性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子反应
- 溶解度
- 导电性(单质、溶液、熔融状态导电)
- 溶液的酸碱性
凡是有离子参加或离子生成的反应都是离子反应。
离子反应包括:复分解反应、氧化还原反应、络合反应、双水解反应
常见阳离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| K+ | 焰色反应 | ①铂丝在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。 | 浅紫色(通过蓝色钴玻璃片观察钾离子焰色) | —— |
| Na+ | 焰色反应 | 火焰分别呈黄色 | ||
| NH4+ | NaOH溶液(浓) | 向未知溶液中加入NaOH浓溶液并加热 | 生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体 | NH4++OH-=NH3↑+H2O |
| Al3+ | 加NaOH溶液 | 向未知溶液中加入NaOH溶液 | 加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中 |
Al3++3OH-=Al(OH)3↓ |
| Cu2+ | 浓氨水 | 向未知溶液中加入浓氨水 | 加入适量浓氨水后生成蓝色沉淀,该沉淀溶于过量浓氨水中,溶液呈深蓝色 |
Cu2++2OH-=Cu(OH)2↓ Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O |
| Ag+ | ①稀盐酸或可溶性盐酸盐②稀HNO3③氨水 | 向未知溶液中加入稀盐酸再加入稀HNO3向过滤出的沉淀中加氨水 | 生成白色沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+ | Ag++Cl-=AgCl↓ |
| Ba2+ | 稀H2SO4或可溶性酸盐溶液 | 向未知溶液中加入稀H2SO4再加入稀HNO3 | 产生白色沉淀,且沉淀不溶于稀HNO3 | Ba2++SO42-=BaSO4↓ |
| Fe3+ | KSCN溶液 | 向未知溶液中加入KSCN溶液或加NaOH溶液或加苯酚 | 变为血红色溶液 | Fe3++3SCN-=Fe(SCN)3 |
| 加NaOH溶液 | 产生红褐色沉淀 | Fe3++3OH-=Fe(OH)3↓ | ||
| 加苯酚 | 溶液显紫色 | Fe3++6C6H6OH→[Fe(C6H5O)]3-+6H+ | ||
| Fe2+ | ①加NaOH溶液 | 向未知溶液中加入NaOH溶液并露置在空气中 | 开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。 | Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| ②KMnO4 (H+)溶液 | 向未知溶液中加入KMnO4(H+)溶液 | KMnO4(H+)紫色褪去 | MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O | |
| ③K3[Fe(CN)6] | 向未知溶液中加入K3[Fe(CN)6]溶液 | 出现蓝色Fe3[Fe(CN)6]2沉淀 | 3Fe2++2[Fe(CN)6]-=Fe3[Fe(CN)6]2↓ | |
| ④KSCN溶液,新制的氯水 | 加入KSCN溶液,新制的氯水 | 加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。 | 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(SCN)3 |
常见阴离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| CO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出无色无味气体 | Ba2++CO32-=BaCO3↓ BaCO3+2H+=Ba2++CO2↑+H2O |
| ②稀盐酸、Ca(OH)2溶液 | 加入稀盐酸后放出的气体通入使澄清的Ca(OH)2溶液 | 加入稀盐酸后放出无色无味气体,通入澄清的Ca(OH)2溶液变浑浊 | CO32-+2H+=H2O+CO2↑ Ca2++2OH-+CO2=CaCO3↓+H2O | |
| SO42- | BaCl2溶液、稀硝酸或稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ba2++SO42-=BaSO4↓ |
| SO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出刺激性气味的气体 | SO32-+2H+=H2O+SO2↑ |
| ②稀盐酸、品红溶液 | 加入稀盐酸后放出的气体通入品红溶液 | 加入稀盐酸后放出的气体使品红溶液褪色 | SO32-+2H+=H2O+SO2↑ | |
| Cl- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ag++Cl-=AgCl↓ |
| Br- | AgNO3溶液、稀硝酸或稀盐酸 | 生成不溶于稀硝酸或稀盐酸的浅黄色沉淀 | Ag++Br-=AgBr↓ | |
| I- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸的黄色沉淀 | Ag++I-=AgI↓ |
| ②新制氯水,淀粉溶液 | 向未知溶液中加入新制氯水,再加入淀粉溶液 | 滴入新制Cl2,振荡后再滴入淀粉溶液,变蓝 | Ag++I-=AgI↓ 2I-+Cl2=I2+2Cl- I2遇淀粉变蓝 |
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
溶解度:
(1)固体物质的溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,单位是g,符号用S表示。
表达式: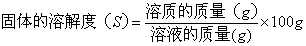
(2)气体的溶解度定义:指该气体在压强为101kPa,一定温度时,溶解在1体积水中达到饱和状态时气体的体积。
溶解度曲线:
- 溶解度曲线由于固体物质的溶解度随温度变化而变化,这种变化可以用溶解度曲线来表示。我们用纵坐标表示溶解度,横坐标表示温度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
- 溶解度曲线的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
溶解度的影响因素:
- 固体物质溶解度的影响因素:溶质,溶剂的种类,温度
- 气体物质溶解度的影响因素:溶质,溶剂的种类,温度,压强
溶解度与温度的关系:
(1)固体物质的溶解度一般随温度的升高而增大,个别物质反常,如Ca(OH)2。
(2)气体物质的溶解度,一般随温度升高而减小,随压强增大而增大。常见的可溶性气体(常温、常压时的体积数):NH3 (700),HCl(0℃时500),HBr、HI亦易溶,SO2(40),C12 (2).H2S(2.6),CO2(1)。难溶气体:H2、CO、NO。有机物中:HCHO易溶,C2H2微溶,CH4、C2H4难溶。
a.大部分固体物质的溶解度随温度的升高而增大,如KNO3、NaNO3等。
b.少数固体物质的溶解度受温度影响很小,如 NaCl。
c.极少数固体物质的溶解度随温度的升高而减小,如 Ca(OH)2
饱和溶液与不饱和溶液、过饱和溶液:
过饱和溶液:一定温度、压力下,当溶液中溶质的浓度已超过该温度、压力下溶质的溶解度,而溶质仍不析出的现象叫过饱和现象,此时的溶液称为过饱和溶液。
饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下,在一定量的溶剂里,还能再溶解某种物质的溶液叫做这种溶质的不饱和溶液。
溶解度曲线:

溶解度曲线的意义:
①表示同一种物质在不同温度时的溶解度;
②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;
③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;
④根据溶解度曲线能进行有关的计算。
溶解度曲线变化规律:
1.大多数固体物质的溶解度随湿度升高而增大,曲线为"陡升型",如硝酸钾。
2.少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型",如氯化钠。
3.极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型",如氢氧化钙。
4.气体物质的溶解度均随湿度的升高而减小(纵坐标表示体积),曲线也为"下降型",如氧气。
溶解度曲线的应用:
1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2.比较相同湿度时(或一定湿度范围内)不同物质溶解度的大小。
3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法。
4.确定溶液的状态(饱和与不饱和)。

溶解度曲线上的点的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
有关溶解度的计算:
某温度下,
1.金属靠自由电子的定向移动而导电,属于物理现象,温度升高时电阻增大,导电能力减弱。电解质溶液靠自由离子的定向移动而导电。电解质溶液(或熔融电解质)在导电的同时要发生化学变化,即被电解。
2.影响电解质溶液导电能力的因素
(1)自由移动离子浓度的大小(主要决定因素):温度一定,离子浓度越大,导电能力越强。
(2)温度:温度越高,导电能力越强(与金属导电相反)。
(3)单个离子所带电荷数:电荷数越高,导电能力越强。例如:氨水中通入少量HCl,原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱,当通入少量HCl 转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强。
3.强电解质溶液的导电能力不一定比弱电解质溶液的强。例如:较浓醋酸的导电能力比极稀HCl溶液强,这是由溶液中自南移动离子浓度大小决定的。又如:CaCO3虽为强电解质,但溶于水所得溶液极稀,自由移动离子的浓度太小,溶液导电能力极差。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
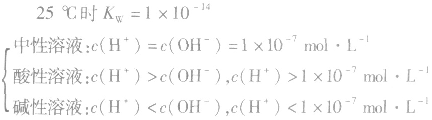
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
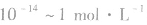 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: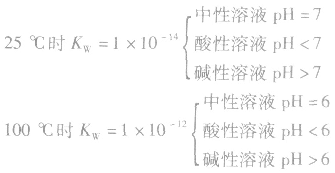
与“化学中常借助图像来表示某种变化过程,下列关于4个图像的说法...”考查相似的试题有:
- 某溶液中含有HCO3-、Na+、Ba2+、NO3-等4种离子,若向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是A.HCO3—B....
- 在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀...
- 某河道两旁有甲、乙两个化工厂。它们排放的澄清工业废水中共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。(1)经测定甲厂的...
- 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
- 有一固体混合物,可能由Na2CO3、Na2SO4、FeSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:① 将固体混合物溶于水中...
- 下列 各图像中,不正确的是[ ]A. N2(g)+3H2(g)=2NH3(g) △H=-92.4kJ/molB. 向弱酸HA的稀溶液中加水稀释C. 有催化剂(a)和无...
- (8分)A、B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、C...
- (改编)25℃时有关物质的颜色和溶度积(KSP)如下表:物质AgC1AgBrAgIAg2S颜色白淡黄黄黑KSP1.8×10-107.7×10-131.5×10-161.8×...
- 如图是A、B两种盐的溶解度随温度变化的曲线,下列有关说法正确的是( )A.若A中混有少量的B,可采用冷却热饱和溶液法提纯AB...
- 下列各组试剂(括号内的是滴加试剂)做溶液导电性实验的过程中,可以观察到灯泡由亮变暗直至熄灭,然后又逐渐变亮的是[ ]A.B...