本试题 “下列各物质不能与水发生反应的是[ ]A.乙苯B.乙烯C.氯乙烷D.乙酸乙酯” 主要考查您对乙烯
苯的同系物
卤代烃
酯
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乙烯
- 苯的同系物
- 卤代烃
- 酯
乙烯的结构和性质:
1.分子结构:
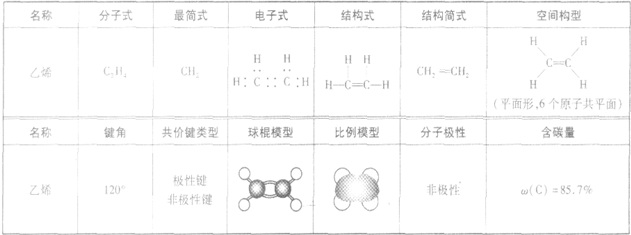
2.物理性质:
在通常状况下,乙烯是无色、稍有气味的气体,难溶于水,易溶于乙醇、乙醚等有机溶剂,密度(标准状况时为1.25g·L-1)比空气略小,因此实验室制取乙烯不用排空气法收集,而用排水法收集。
3.化学性质:
由于碳碳双键中的一个键易断裂,刚此乙烯的性质比较活泼,能发生加成、加聚反应,能使溴水和KMnO4溶液(酸性)褪色。
(1)乙烯易发生氧化反应
①乙烯的燃烧
乙烯在氧气或空气中易燃烧,完全燃烧生成CO2和H2O,反应的化学方程式为:
乙烯含碳量比较高,在一般情况下燃烧不是很充分,因此火焰明亮且伴有黑烟。
②乙烯的催化氧化

③乙烯能被酸性KMnO4溶液氧化
乙烯使酸性KMnO4溶液褪色的实质是乙烯被酸性KMnO4溶液氧化成二氧化碳和水。
(2)乙烯能发生加成反应
有机物分子中不饱和碳原子与其他原子(或原子团) 直接结合生成新的化合物的反应叫做加成反应。
乙烯使溴的四氯化碳溶液褪色的实质是乙烯与溴单质发生加成反应生成了1,2一二溴乙烷,反应的化学方程式为: 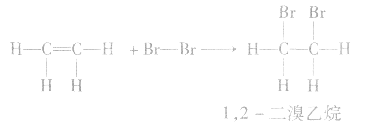
通常简写为
因此,可用溴水或溴的四氯化碳溶液鉴别乙烯和甲烷、乙烷等烷烃,也可用于除去甲烷中混有的乙烯。
(3)加聚反应在一定条件(温度、压强、催化剂)下,乙烯能发生加聚反应:
由相对分子质量小的化合物(单体)分子互相结合成相对分子质量很大的高分子的反应叫做聚合反应。由一种或多种不饱和化合物(单体)分子通过不饱和键互相加成而聚合成高分子化合物的反应叫做加成聚合反应,简称加聚反应。
乙烯的鉴别和除杂:
1.乙烯和其他物质的鉴别利用被鉴别物质性质的差异进行区分,要求操作简单、安全,现象明显,结论准确,以乙烷与乙烯的鉴别为例。操作:将两种气体分别通人酸性KMnO4溶液中。现象:一种气体使酸性KMnO4溶液褪色,一种气体不能使酸性KMnO4溶液褪色。结论:使酸性KMnO4溶液褪色者为乙烯,不能使酸性KMnO4溶液褪色者为乙烷.
2.除杂质乙烯除杂要求:将杂质除净,不能引入新杂质,小能对主要成分产生不利影响。如乙烷中混有乙烯,除杂的方法是用溴水洗气,乙烯与溴发生加成反应破除去,乙烷不反应逸出。
苯的同系物:
(1)概念苯的同系物是指苯环上的氧原子被烷基取代的产物,如甲苯(C7H8)、二甲苯(C8H10)等。苯的同系物的通式为
(2)简单苯的同系物的物理性质甲苯、二甲苯、乙苯等简单的苯的同系物,在通常状况下都是无色液体,有特殊的气味,密度小于1g· cm-3,不溶于水,易溶于有机溶剂,本身也是有机溶剂。
(3)苯的同系物的化学性质苯环和烷基的相互作用会对苯的同系物的化学性质产生一定的影响。如苯环使甲基的还原性增强,甲基使苯环上邻、对位氢原子更易被取代。
①苯的同系物的氧化反应:苯的同系物(如甲苯) 能使酸性KMnO4溶液褪色。
注意:甲苯、二甲苯等苯的同系物被酸性 KMnO4溶液氧化,被氧化的是侧链。如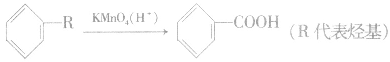
但有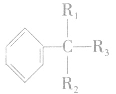 结构的苯的同系物则不能被 KMnO4(H+)溶液氧化。侧链上的氧化反应是苯环对侧链(烷基)影响的结果,说明了苯环上的烷基比烷烃性质活泼。
结构的苯的同系物则不能被 KMnO4(H+)溶液氧化。侧链上的氧化反应是苯环对侧链(烷基)影响的结果,说明了苯环上的烷基比烷烃性质活泼。
②苯的同系物的硝化反应,甲苯跟浓HNO3和浓H2SO4的混合酸可以发生反应,苯环上的氢原子被硝基取代,可以发生一硝基取代、三硝基取代等。
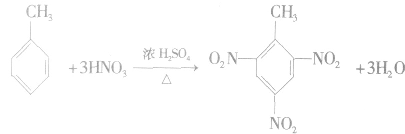
注意:甲苯比苯更易发生硝化反应,这说明受烷基的影响,苯的同系物分子里的苯环比苯分子性质更活泼,而且使苯环上烷基的邻、对位H原子更活泼。
③苯的同系物的加成反应:苯的同系物还能发生加成反应。如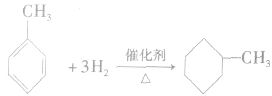
注意:发生加成反应:苯、苯的同系物比烯烃、炔烃困难。
卤代烃:
1.卤代烃的定义
烃分子中的氢原子被卤素原于取代后生成的化合物,称为卤代烃,可用R—X(X为卤素原子)表示。在卤代烃分子中,卤素原子是官能团。由于卤素原子吸引电子的能力较强,使共用电子对偏移,c—x键具有较强的极性,因此卤代烃的反应活性增强。
2.卤代烃的分类 (1)根据分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃和碘代烃。
(2)根据分子中所含卤素原子个数的不同,分为一卤代烃和多卤代烃。
(3)根据烃基结构不同,分为卤代烷烃、卤代烯烃、卤代芳香烃等。
卤代烃的性质:
1.卤代烃的物理性质
(1)常温下,卤代烃中除一氯甲烷、氯乙烷、氯乙烯等少数为气体外,其余为液体或固体。
(2)一氯代烷的物理性质:随着碳原子数增加,其熔、沸点和密度逐渐增大(沸点和熔点大于相应的烃)。
(3)难溶于水,易溶于有机溶剂,除脂肪烃的一氟代物、一氯代物等部分卤代烃外,液态卤代烃的密度一般比水大。密度一般随烃基中碳原子数增加而增大。
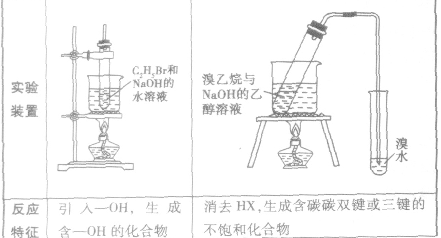
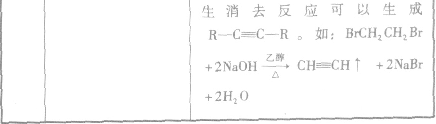
2.卤代烃的化学性质与C2H5Br相似,可以发生水解反应和消去反应

卤代烃中卤素的检验:
1.实验原理
根据AgX的颜色(白色、淡黄色、黄色)可确定卤素(氯、溴、碘):
2.实验步骤
①取少量卤代烃;
②加入NaOH溶液;
③加热煮沸;
④加入过量稀硝酸酸化;
⑤加入AgNO3溶液。
3.实验说明加热煮沸是为了加快水解速率,因不同的卤代烃水解难易程度不同;加入过量稀硝酸酸化是为了中和过量的NaOH,防止NaOH与AgNO3反应,干扰实验现象,同时也是为了检验生成的沉淀是否溶于稀硝酸。
卤代烃在有机物转化和合成中的重要桥梁作用:
1.一元代物与二元代物之间的转化关系 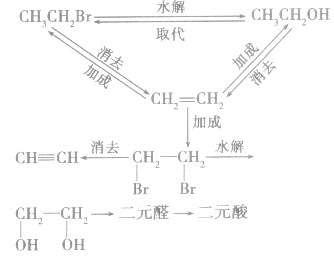
2.卤代烃的桥梁作用通过烷烃、芳香烃与X2发生取代反应,烯烃、炔烃与X2、HX发生加成反应等途径可向有机物分子中引入一X;而卤代烃的水解和消去反应均消去一X。卤代烃发生取代、消去反应后,可在更大的空间上与醇、醛、酯相联系。引入卤素原子常常是改变性能的第一步,卤代烃在有机物转化、推断、合成巾具有“桥梁”的重要地位和作用。
溴乙烷:
1.分子结构
分子式: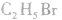
结构式: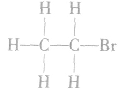
电子式: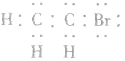
结构简式: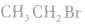
2.溴乙烷的物理性质纯净的溴乙烷是无色液体,沸点为38.4℃,密度比水大,难溶于水,易溶于乙醇等多种有机溶剂。
3.溴乙烷的化学性质
(1)水解反应:溴乙烷在NaOH存在的条件下可以跟水发生反应生成乙醇和溴化氢。 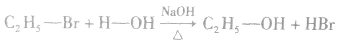
说明:溴乙烷的水解反应又属于取代反应。
溴乙烷水解生成的HBr与NaOH易发生中和反应,水解方程式也可写为:

(2)消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX)而生成含不饱和键(双键或三键)化合物的反应,叫做消去反应。
溴乙烷与强碱(NaOH或KOH)的乙醇溶液共热,从溴乙烷分子中脱去HBr,生成乙烯: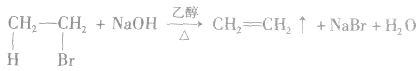
1.概念及通式:
酸(羧酸或无机含氧酸)和醇起反应生成的一类化合物叫酯。如:
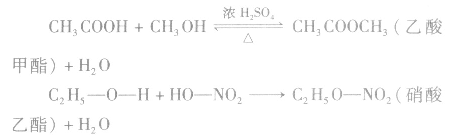
酯的通式为
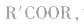 官能团是
官能团是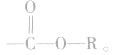 饱和一元羧酸和饱和一元醇形成的酯的通式为
饱和一元羧酸和饱和一元醇形成的酯的通式为 (n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。
(n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。2.分类
根据生成酯的酸的不同,酯可分为有机酸酯和无机酸酯,通常所说的酯是指有机酸(羧酸)酯。
3.书写及命名——某酸某酯
根据生成酯的酸和醇对酯进行命名:如:

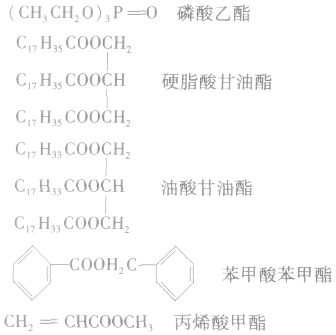
4.酯的存在酯类广泛存在于自然界中,如苹果里含有戊酸戊酯,香蕉里含有乙酸异戊酯等。
酯的性质:
1.酯的物理性质
低级酯是具有芳香气味的液体,密度一般小于水,并难溶于水,易溶于有机溶剂。
2.酯的化学性质
在酸或碱催化的条件下,酯可以发生水解反应,能得到相应的酸和醇。酯在酸性条件下的水解反应是可逆反应。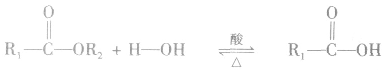
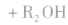
酯在碱性条件下的水解程度大于在酸性条件下的水解程度,其主要原因是在碱性条件下,酯水解生成的羧酸可以与碱发生反应,使羧酸浓度减小,即减小了生成物的浓度,化学平衡向正反应方向移动,使酯的水解程度增大。
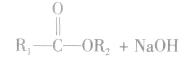
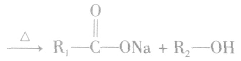
3.酯的用途酯具有广泛的用途。很多香精、药物本身就是酯。例如,广泛用于农业生产和家庭除虫的低毒高效杀虫药拟除虫菊酯就是一种酯,某些抗生素如红霉素为大环内酯类抗生素,也属于酯。日常生活中的饮料、糖果和糕点等常使用酯类物质作为香料。液态的酯可用作有机溶剂。
酯化反应的规律归纳:
1.酯化反应中量的变化
(1)酯化反应发生时,每有1mol酯基“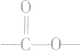 ”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
2.酯化反应前后碳链结构的变化规律
在下列一系列变化中,分子中的碳链结构不变:醇 醛
醛 羧酸
羧酸 酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
3.酯化反应的反应条件
酯化反应是可逆反应,逆反应是酯的水解。羧酸和醇的酯化反应速率很慢,冈此,酯化反应通常要在加热并加催化剂(浓硫酸)的条件下进行。之所以用浓硫酸而不用稀硫酸是因为浓硫酸除起催化作用外,还可作吸水剂吸收酯化反应生成的水,有利于反应向生成酯的方向进行。酯化反应巾的浓硫酸,可用浓磷酸
与“下列各物质不能与水发生反应的是[ ]A.乙苯B.乙烯C.氯乙烷D...”考查相似的试题有:
- 下列反应属于加成反应的是( )A.C3H8+Cl2C3H7Cl+HClB.2FeCl2+Cl2=2FeCl3C.CH2=CH2+H2OCH3CH2OHD.CH3CH2OHCH2=CH2↑+H2O
- 下列物质一定不能发生加成反应的是A.C2H6B.C2H4C.C3H6D.C2H2
- 下列判断正确的是[ ]A.可用油脂萃取溴水中的Br2B.可用热的饱和碳酸钠溶液除去废旧金属表面的矿物油C.汽油、淀粉、油脂、蛋...
- (6分)已知某有机物的结构简式为:CH2=CH2(1)该有机物中所含官能团的名称是 ;(2)该有机物发生加聚反应后,所得产物的...
- 某种兴奋剂的结构简式如图所示,有关该物质的说法中不正确的是( )A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物B.该...
- 维生素A的结构简式如下图所示,关于它的叙述中正确的是A.维生素A属于烃B.维生素A不能与金属钠反应产生氢气C.维生素A不能使...
- 下列关于有机物的说法,正确的是[ ]A.甲烷、乙烯和苯都能和溴水发生加成反应B.用NaOH溶液可除去乙酸乙酯中的乙酸C.石油分...
- 已知C-C单键可以绕键轴旋转,某结构简式可表示为烃,下列说法中正确的是( )A.分子中至少有9个碳原子处于同一平面上B.该烃...
- 已知A是卤代烃,C是高分子化合物,H是一种环状酯。转化关系如下衅所示。回答下列问题: (1)A的分子式 ;D越的反应类型: ,...
- 分别将下列各组物质等体积混合,在室温下剧烈振荡,静置后,能够形成均一溶液的是[ ]A.苯、碘水B.苯酚、水C.乙醇、水D.乙...