本试题 “10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生以下变化:(1)甲同学认为,该溶液pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为____。...” 主要考查您对碳酸氢钠
盐水解的影响因素
水解方程式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳酸氢钠
- 盐水解的影响因素
- 水解方程式
碳酸氢钠(NaHCO3):
(1)俗名:小苏打;细小白色晶体,溶解度小于Na2CO3,受热易分解,可用于治疗胃酸过多、发酵剂
(2)与H+反应:HCO3-+H+==CO2↑+H2O
(3)与NaOH反应:HCO3-+OH-==CO32-+H2O
(4)与石灰水反应:生成CaCO3沉淀
(5)与BaCl2和CO2不反应
碳酸氢钠的物理性质:
碳酸氢钠为白色晶体,或不透明单斜晶系细微结晶。比重2.15g。无臭、味咸,可溶于水,不溶于乙醇。其水溶液因水解而呈微碱性,常温中性质稳定,受热易分解,在50℃以上迅速分解,在270℃时完全失去二氧化碳,在干燥空气中无变化,在潮湿空气中缓慢分解。溶解度:7.8g,18℃;16.0g,60℃。
碳酸氢钠的用途:
碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:
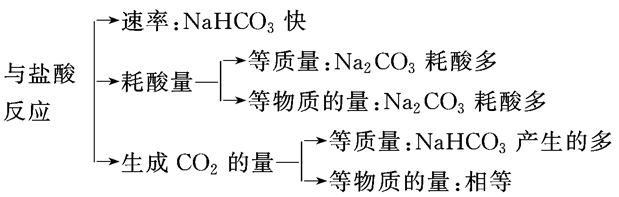
碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对
 水解平衡
水解平衡
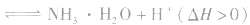 的影响
的影响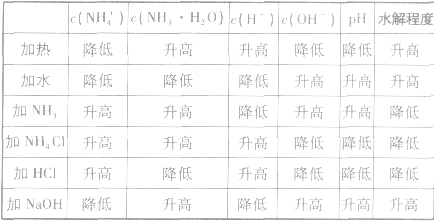
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
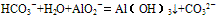
盐类水解程度大小比较规律:
1.盐水解生成的弱酸(或弱碱)越弱,水解程度越大。常据此判断弱酸(或弱碱)的相对强弱:如等浓度的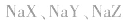 三种盐溶液,pH依次增大,则弱酸根离子
三种盐溶液,pH依次增大,则弱酸根离子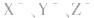 的水解程度依次增大,所以酸性HX>HY>HZ。
的水解程度依次增大,所以酸性HX>HY>HZ。
2.相同条件下:正盐>相应酸式盐。如水解程度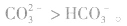
3.相互促进水解的盐>单水解的盐>相互抑制水解的盐。如水解程度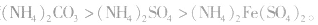
1、定义:表示盐水解的式子。
2、书写水解方程式的注意事项:
(1)找出盐类组成中会发生水解的离子(弱酸阴离子或弱碱阳离子),直接写出盐类水解的离子方程式。
(2)盐类的水解反应是中和反应的逆反应,中和反应的程度很大,水解反应的程度很小,故写盐类的水解反应方程式或离子方程式时,一般不写“=”而写“
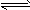 ”。
”。 (3)一般盐类水解的程度很小,水解产物也少,通常不生成沉淀或气体,也不发生分解。在书写盐类水解的离子方程式时一般不标“↑”或“↓”,也不把生成物(如NH3·H2O、H2CO3)写成其分解产物的形式。
(4)多元弱酸的盐中弱酸根离子分步水解,第一步比较容易发生,第二步比第一步难。水解时以第一步为主。多元弱酸的水解反应式应分步书写,而多元弱碱的水解反应不分步书写。
(5)某些盐溶液在混合时,由于一种盐的阳离子和另一种盐的阴离子都能发生水解,水解后溶液的性质相反,它们在一起时就能相互促进对方的水解,使两种离子的水解趋于完全。称为双水解。如:铝盐和碳酸盐混合:
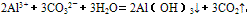 ,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。
,双水解反应中如果有复分解反应的条件(沉淀、气体、水等生成),则反应比较完全。书写时一般用“=”,标“↑”或“↓”。盐类水解方程式的书写:
一般来说,盐类水解的程度不大,应该用可逆号“ ”表示,盐类水解一般不会产生沉淀和气体,所以不用“↑”“↓”符号表示。
”表示,盐类水解一般不会产生沉淀和气体,所以不用“↑”“↓”符号表示。
1.一元弱酸的强碱盐和一元弱碱的强酸盐的水解。 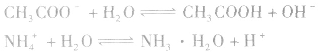
2.多元弱酸的强碱盐的水解是分步进行的,不能合并,以第一步为主。 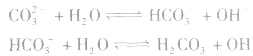
3.多元弱碱的强酸盐的水解。 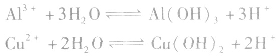
4.弱酸的铵盐的水解。 
5.完全双水解的离子间的反应用“==”表示,标明“↑”“↓”符号。如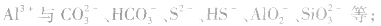


与“10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生以下变化:(1)...”考查相似的试题有:
- l mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是[ ]A. Na2CO3B...
- 下列叙述中正确的是 ( )A.明矾、硫酸铁都可以用于净水,但净水原理不同B.粗铝做阳极,硫酸铝溶液做电解液,电解精炼铝C....
- 一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2OCH3COOH+OH-,下列说法正确的是A.加入少量NaOH固体,c(CH3COO-)增大B...
- 某酸式盐NaHY的水溶液c(OH-)>c(H+),下列叙述正确的是A.H2Y的电离方程式:H2Y2H++Y2-B.HY-的水解方程式:HY-+ H2OH3O++ Y2-...
- 下列过程或现象与盐类水解无关的是( )A.热的纯碱液用于去油污B.加热氯化铁溶液颜色变深C.饱和食盐水使甲基橙显黄色D.泡...
- 醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1mol/L醋酸钡溶液中粒子浓度的比较,其中错误的的是A.c(Ba2+) >c(CH3C...
- 向10.00 mL 0.01 mol/L某一元酸HA溶液中逐滴加入0.01 mol/L NaOH 溶液,溶液pH变化曲线如图所示。下列说法不正确的是[ ]A.HA...
- 下列各组离子中,因相互促进水解,而不能大量共存的是( )A.OH-、Na+、K+、HCO3-B.Na+、HCO3-、Fe3+、Cl-C.H+、HS-、Na+、S...
- 常温下,在10 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量...
- 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,下列关系式中正确的是A.c (Na+)=2c(CH3COO-)+2c(CH3COOH)B.c(H+)=c(C...