本试题 “已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是酸电离平衡常数醋酸K i=1.75×10-5次氯酸K i=2.98×10-8碳酸Ki1=4.30×10-7Ki2=5.61×...” 主要考查您对弱电解质电离的影响因素
弱电解质的电离度
弱电解质的电离
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质电离的影响因素
- 弱电解质的电离度
- 弱电解质的电离
电离平衡的影响因素:
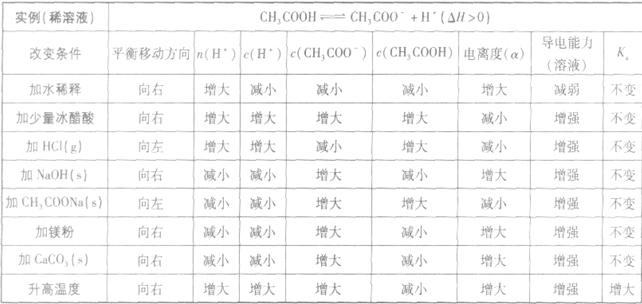
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:

电离度:
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: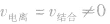 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
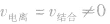 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
发现相似题
与“已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下...”考查相似的试题有:
- 在相同温度下,100 mL0.01 mol·L-1的醋酸溶液与10 mL0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是A.中和时所...
- 下列电离方程式正确的是A.H2S2H++ S2-B.HF = H++ F-C.NaHSO3= Na++ H++SO32-D.H2CO3+ H2OH3O++ HCO3-
- 部分弱酸的电离平衡常数如下表:弱酸HCOOHHCNH2CO3电离平衡常数(25℃)Ka=1.77×10-4Ka=4.9×10-10Ka1=4.3×10-7Ka2=5.6×10-11下...
- 下列关于强、弱电解质的叙述,有错误的是( )A.强电解质在溶液中完全电离,不存在电离平衡B.在溶液中,导电能力强的电解质...
- 用水稀释时,溶液中随着水量的增加而减小的是A.B.C.c(H+)和c( OH-)的乘积D.OH-的物质的量
- 物质的量浓度各为0.1mol•L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液呈酸性.下列关系式正确的是( )A.[Na+]+[H+]=[CH3C...
- 等体积的0.5mol•L-1的盐酸、0.5mol•L-1CH3COOH溶液,说法错误的是( )A.导电能力:相同B.导电能力:前者大于后者C.溶液中...
- 氯化钴溶液中存在下列平衡:CoCl42-(蓝色)Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是A.由蓝...
- 2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所...
- 将0.1mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )A.CH3COOH电离程度变大B.溶液的pH值变小C.溶液的导...