本试题 “下列关于铁的说法中正确的是[ ]A.纯铁比生铁硬B.铁矿石、焦炭、石灰石是高炉炼铁的原料C.可用铁制容器配制波尔多液D.铁锈能阻碍里层的铁继续与氧气、水等...” 主要考查您对合金
金属的锈蚀与防护
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 合金
- 金属的锈蚀与防护
合金的概念:
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类
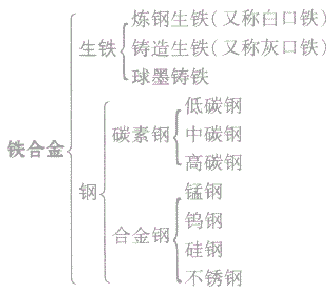
(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
| 含碳量 | 2%—4% | 0.03%—2% |
| 其他元素 | Si、Mn、S、P(少量) | Si、Mn等 |
| 机械性能 | 硬而脆,无韧性 | 坚硬,韧性大,塑性好,有弹性 |
| 机械加工性质 | 可铸不可锻 | 可铸,可锻,可压延 |
| 分类 | 白口铁,灰口铁,球墨铸铁 | 碳素钢,合金钢 |
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类

(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
金属锈蚀:
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
| 实验装置 | 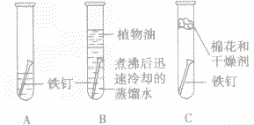 |
| 实验现象 | 几天后观察A试管中铁钉生锈,在水面附近锈蚀 严重,B,C试管中的铁钉没有生锈 |
| 实验分析 | A试管中的铁钉同时跟水、空气(或氧气)接触而生锈; B试管中的铁钉只与水接触不生锈; C 试管中的铁钉只与干燥的空气(或氧气)接触不生锈 |
| 实验结论 | 铁生锈的条件是与水、空气(或氧气)同时接触 |
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
发现相似题
与“下列关于铁的说法中正确的是[ ]A.纯铁比生铁硬B.铁矿石、焦...”考查相似的试题有:
- 我国在春秋战国时期就开始将生铁经高温锻打处理得到相当于铸钢的器具(如锋利的宝剑),这一技术比欧洲早了近2000年.高温锻...
- 下列不属于合金的是A.焊锡B.黄铜C.生铁D.金刚石
- 说到“行”,离不开金属材料(1)下列材料属于合金的是______A.不锈钢 B.硬铝 C.氧化铝陶瓷 D.纳米碳管 E.玻璃钢 F.武德...
- 江苏“铁本事件”去年被国务院查处后,所有在建项目当即停工,一年多来,许多机械设备上早已锈迹斑斑.小霖将一枚生锈的铁螺丝...
- 通过对金属和金属材料的学习,你认为下列做法正确的是( )A.将硫酸铜溶液盛放在铁桶里B.要制取2g氢气,用56g生铁与足量的...
- 化学就在我们身边,它与我们的生活息息相关。(1)多吃蔬菜、水果有益健康,主要原因是蔬菜、水果中富含营养素中的_______。(2)...
- 有些食品袋里装有一小袋铁粉作保鲜剂,有人称它为“双吸剂”,这里的“双吸”是吸收空气中的 这两种物质。有一袋铁粉使用了一段时...
- 光亮的铁在下列情况下最易生锈的是[ ]A.B.C.D.
- 下面是某同学对铁部分知识学习的过程.(1)对铁制品生绣的情况调查:从调查中可知铁制品生锈的主要条件是_________.(2)通...
- 在包装某些食品时,通常放入一小包CaO粉末作为保鲜剂,其作用是______;这种保鲜剂会与空气中的某些成分反应,久置后最终生成...