本试题 “硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:方案一:取标准状态下的空气V L(内含N2、O2...” 主要考查您对二氧化硫
测定物质组成、成分含量
通过实验装置图判断实验的可行性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化硫
- 测定物质组成、成分含量
- 通过实验装置图判断实验的可行性
二氧化硫:
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的制备:
工业制法:

实验室制法:
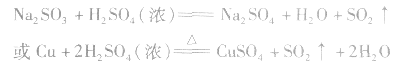
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液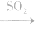 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


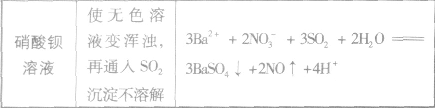
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表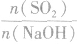 ,如下数轴所示:
,如下数轴所示: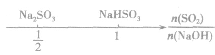
分析数轴可得:
(1)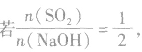 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)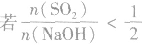 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)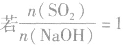 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)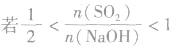 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)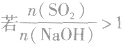 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
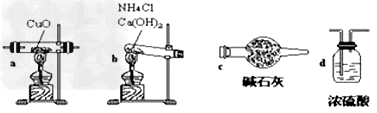
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
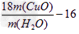
通过实验装置图判断实验的可行性:
1.红磷转换成白磷装置图
2.氨气易溶于水(喷泉实验)

3.氯化铵受热分解
4.铵盐与碱反应
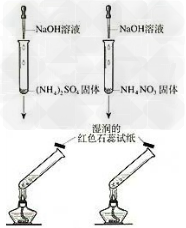
5.实验室制取氨气装置图

6.铝热反应实验装置
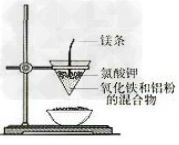
7.铁与水蒸气反应实验装置图

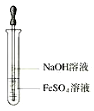
8.氢氧化亚铁的生成
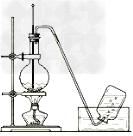
9.实验室制取乙烯的装置图
10.乙烯使高锰酸钾、溴水褪色

11.乙炔的制取和燃烧
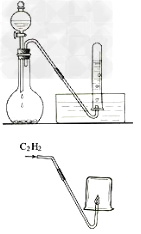
12.乙炔使溴水褪色
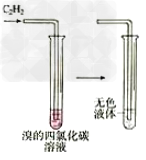
13.苯不能使高锰酸钾褪色

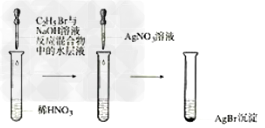
14.溴乙烷的水解反应
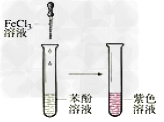
15.苯酚的显色反应
16.乙酸乙酯的制备

17.油脂的水解
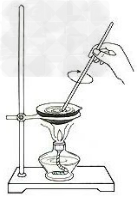
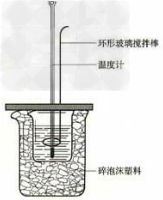
18.中和热的测定
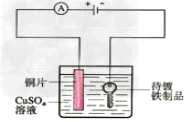
19.电镀铜实验装置
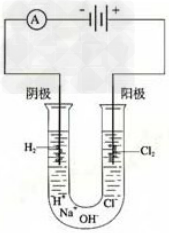
20.点解饱和食盐水
1.红磷转换成白磷装置图

2.氨气易溶于水(喷泉实验)

3.氯化铵受热分解

4.铵盐与碱反应

5.实验室制取氨气装置图

6.铝热反应实验装置

7.铁与水蒸气反应实验装置图

8.氢氧化亚铁的生成

9.实验室制取乙烯的装置图

10.乙烯使高锰酸钾、溴水褪色

11.乙炔的制取和燃烧

12.乙炔使溴水褪色

13.苯不能使高锰酸钾褪色

14.溴乙烷的水解反应

15.苯酚的显色反应

16.乙酸乙酯的制备

17.油脂的水解

18.中和热的测定

19.电镀铜实验装置

20.点解饱和食盐水

发现相似题
与“硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为...”考查相似的试题有:
- 已知NH4CuSO3与足量的1mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判...
- 下列几种物质均能使品红褪色,其中有一种物质使品红褪色的原理与其他几种不同,该物质是( )A.过氧化钠 B.臭氧 C.二氧化...
- 已知A、B、C、D四种物质,都含有一种共同的元素,它们相互转化的关系如图所示(1)根据以上信息推断:A_________,B_________,...
- X、Y、Z为前18号元素中三种不同的非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→ B(气)。请针对以下两种不同...
- 下图是实验室中制备气体或验证气体性质的装置图(1)仪器a的名称是______________。(2)利用上图装置制备纯净、干燥的氯气。...
- 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。(已知:2SO2(g)+O2(g)2SO3(g) △H= -196.6 KJ·mol-1...
- 有一包白色固体,可能由:CuSO4、Na2SO4、NaNO3、Na2CO3、BaCl2、NaCl 中的一种或几种组成.为了判断其中的成份,某同学设计...
- 碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种。(1)现采用氢气还原法,请回答如下问题:①写...
- 现有某铝合金,合金中除含Al单质外,还可能含有Cu、Fe、Mg、Si、Al2O3中的一种。为了测定该铝合金中铝元素的质量分数,某化学...
- 下图所示的实验装置不能达到实验目的的是[ ]A. 结合秒表测量锌与硫酸的反应速率B. 测定中和反应的反应热C. 验证化学能转化为...