本试题 “(12分)在标准状况下,将224LHCl气体溶于635mL水(ρ=1.0g·cm—3)中,所得盐酸的密度为1.18 g·cm—3。试计算:(1)所得盐酸的物质的量浓度为 。(2)取出这种...” 主要考查您对物质的量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的量
物质的量:
物质中含有一定数目粒子集体的物理量。是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度、质量、时间、电流强度、发光强度、温度、物质的量)符号:n
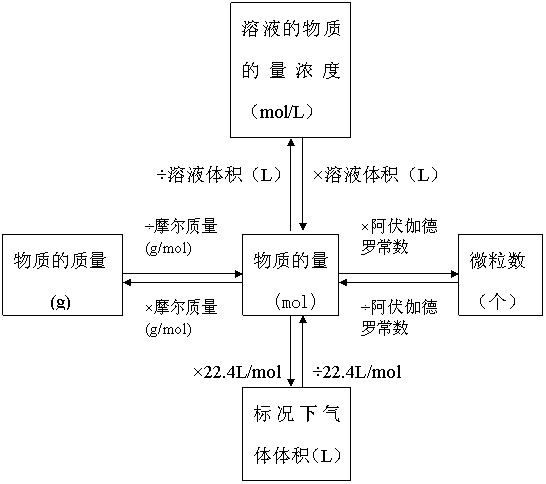
计算公式:物质的量(n)=粒子数(N)/阿伏加德罗常数(NA) 以物质的量为中心的各种化学常用量间的关系:n=N/NA=m/M=V/Vm=cV=ρV/M
物质中含有一定数目粒子集体的物理量。是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度、质量、时间、电流强度、发光强度、温度、物质的量)符号:n
计算公式:物质的量(n)=粒子数(N)/阿伏加德罗常数(NA) 以物质的量为中心的各种化学常用量间的关系:n=N/NA=m/M=V/Vm=cV=ρV/M
使用物质的量注意事项:
(1)物质的量表示物质所含指定粒子的多少,物质的量是一个整体,不得简化或增添任何字。
(2)物质的量及其单位摩尔的适用范围是微观粒子,因此在使用中应指明粒子的名称。
物质的量的相关解法:
问题探究:
(1)1mol氢这种说法正确吗?如何表示1mol氢原子、1mol氢分子、1mol氢离子?
答:使用摩尔作单位时,应用化学式(符号)指明离子的种类,1mol氢的说法不正确,因其咩有指明是氢分子还是氢离子、氢原子。1mol氢原子、1mol氢分子、1mol氢离子分别表示为1molH、1molH2、1molH+。
(2)阿佛加德罗常数和6.02×1023mol-1在实际使用上有何区别?
阿佛加德罗常数是一个非常精确的数字,而6.02×1023mol-1只是阿佛加德罗常数的一个近似值。在关于概念性描述时要求非常准确,要使用阿佛加德罗常数,而在涉及计算时,则用6.02×1023mol-1进行粗略计算。二者关系类似于数学上的圆周率∏与3.14的关系。
发现相似题
与“(12分)在标准状况下,将224LHCl气体溶于635mL水(ρ=1.0g·cm...”考查相似的试题有:
- 设NA为阿伏加德罗常数的数值,下列说法正确的是A.84gNaHCO3晶体中含有NA个CO32-B.15.6 g Na2O2与过量CO2反应时,转移的电子...
- 下列能表示阿伏加德罗常数数值的是A.1molH2含有的电子数 B.通常状况下,22.4LCO2所含的分子数C.0.012kg12C所含的原子数 D...
- 含有相同氧原子数的CO2和CO的物质的量之比为( ) A.1:1B.2:3C.1:2D.2:1
- 将等体积等物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中的Cl-完全沉淀,则需等物质的量浓度的AgNO3溶液的体积比为A.1∶2∶3B....
- 小苏打、胃舒平、达喜都是常用的中和胃酸的药物。(1)小苏打每片含0.50gNaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是 m...
- 用NA表示阿伏加德罗常数的值,下到叙述正确的是 ( )A.常温下,4.6gNa和足量的O2完全反应失去电子数为0.2NAB.标准状况下,...
- 设NA表示阿伏加德罗常数,下列叙述中正确的是 A.5.6g Fe与足量稀盐酸反应转移的电子数为0.3NAB.0.2 mol /L CaCl2溶液中含有...
- 将一定量的PH3和H2的混合气体,依次通过两支加热的硬质玻璃管,第一支装有足量的铜屑,第二支装有足量的CuO。第一支玻璃管中...
- 用NA表示阿伏德罗常数,下列叙述正确的是A.标准状况下,22.4LH2O含有的分子数为 NAB.常温常压下,1.06g Na2CO3含有的Na+离...
- 下列说法正确的是[ ]A.1molO2和1molN2 所占体积都约为22.4LB.H2的气体摩尔体积约为22.4LC.在标况下,1molH2和1molH2O所占...