本试题 “A、B、C、D、E都是短周期元素,原子序数依次增大,五种元素核电荷总数为42,B、C同周期,A、D同主族.A、B能形成两种液态化合物甲和乙,原子个数比分别为2:1...” 主要考查您对晶胞
极性键、非极性键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 晶胞
- 极性键、非极性键
晶胞:
1.定义描述晶体结构的基本单元叫做晶胞。
2.结构一般来说,晶胞为平行六面体,晶胞只是晶体微观空间里的一个基本单元,在它的上、下、左、右、前、后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。“无隙”是指相邻晶胞之间没有任何间隙,“并置”是指所有晶胞都是平行排列的,取向相同。
晶胞中微粒数目的确定:
计算晶胞中微粒数目的常用方法是均摊法。均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞。
属于这个晶胞。
(1)长方体(或正方体)形晶胞中不同位置的粒子数的计算。
①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有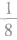 属于该晶胞。
属于该晶胞。
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有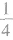 属于该晶胞。
属于该晶胞。
③处于面上的粒子,同时为2个晶胞所共有。每个粒子有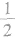 属于该晶胞。
属于该晶胞。
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成许多个六边形,其顶点(1个碳原子)对六边形的贡献为 ,那么每一个六边形实际有6×
,那么每一个六边形实际有6× =2个碳原子。
=2个碳原子。
(3)在六棱柱晶胞(如图所示 MgB2的晶胞)中,顶点上的原子为6 个晶胞(同层3个,上层或下层3个) 共有,面上的原子为2个晶胞共有,因此镁原子个数为12×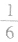 +2×
+2×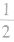 =3,硼原子个数为6。
=3,硼原子个数为6。 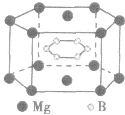
特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定式,不同形状的晶胞应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心上的原子依次被6、3、4、2 个晶胞共用。
有关晶胞密度的计算步骤:
①根据“分摊法”算出每个晶胞实际含有各类原子的个数,计算出晶胞的质量m:
②根据边长计算晶胞的体积V:
③根据 进行计算,得出结果。
进行计算,得出结果。
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: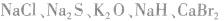 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: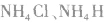 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(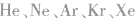 等)。
等)。
与“A、B、C、D、E都是短周期元素,原子序数依次增大,五种元素核...”考查相似的试题有:
- 下列有关晶体的叙述中错误的是A.石墨的层状结构中由共价键形成的最小的碳环上有六个碳原子B.氯化钠晶体中每个Na+周围紧邻的...
- A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K...
- 最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸...
- 下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是 ( )A.碘和氯化钾B.金刚石和重晶石C.二...
- A.CH4>GeH4>SnH4B.KCl>NaCl>MgCl2>MgOC.Rb>K>Na>LiD.石墨>金刚石>SiO2>MgO
- 如果1 mol金属钠的质量为23 g,密度ρ=0.97 g·cm-3,则每个钠原子的半径约为多少?(设钠为紧密堆积的球体)
- 镍(Ni)可形成多种配合物,且各种配合物均有广泛的用途。(1)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO...
- 下列性质中,能充分说明某晶体是离子晶体的是 ( )A.具有较高的熔点B.固态不导电,水溶液能导电C.可溶于水D.固态不导电,...
- 下列分子中属于含有极性键的非极性分子,且分子中各原子最外层都满足8电子稳定结构的是( )A.CH4B.PCl3C.SiCl4D.XeF4
- 近期报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80Mpa下合成出金刚石,具有深远意义。下列说法不正确的是[ ...