本试题 “电子是组成原子的基本粒子之一。下列对电子的说法中正确的是( )A.密立根发现电子,汤姆生最早测量出电子电荷量为1.6×10-19CB.氢原子的电子由激发态向基态...” 主要考查您对光电效应实验规律
电子的发现
α、β、γ射线
氢原子的能级
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 光电效应实验规律
- 电子的发现
- α、β、γ射线
- 氢原子的能级
1、在光的照射下物体发射电子的现象叫光电效应。(下图装置中,用弧光灯照射锌版,有电子从锌版表面飞出,使原来不带电的验电器带正电。)

2、光电效应的实验规律

知识扩展:
为什么电子不能一次吸收多个光子而发生光电效应
由于电子非常小,能够捕获光子的几率就非常小,而同时捕获两个光子的几率就更小,有人计算过,一个电子同时捕获两个光子的几率大约为10-34。故可认为一个电子一次只能吸收一个光子。
那么电子为什么不能吸收一个光子后再吸收一个光子从而积累够发生光电效应所需的能量呢?因电子吸收光子的能量后,立即就发生剧烈的热运动,把获得的能量迅速向周围传递开去。到捕获到下一个光子时,原获得的能量早就消耗完了。而在原获得的能量消耗完之前另捕获一个光子,就要求捕获两光子的时间间隔极短。而在极短时间内捕获第二个光子的几率与同时捕获两个光子的几率差别不大(严格说此几率的大小与时间间隔长短有关,时间间隔越长,捕获两个光子的几率就越大,但此时间间隔要求极短)。
电子的发现:
| 阴极射线 | 产生 | 在研究气体导电的玻璃管内有阴、阳两极。当两极间加一定电压时,阴极便发出一种射线,这种射线为阴极射线 |
| 特点 | 轰击荧光物质时能使其发光 | |
| 组成 | 电子流 | |
| 电子 | 质量 | 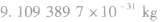 |
| 电荷量 | 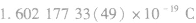 | |
| 比荷 | 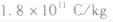 | |
| 发现 | 1897年,英国物理学家汤姆孙测出了阴极射线粒子的比荷,断定它是带负电的粒子,后来被称为电子 | |
| 意义 | 电子是人类发现的第一个比原子小的粒子。电子的发现,打破了原子不可再分的传统观念,使人们认识到原子不是组成物质的最小微粒,原子本身也有内部结构。从此,原子物理学飞速发展,人们对物质结构的认识进入了一个新时代 | |
| 密立根实验 | ||
| 电子电荷的精确测定是在1909—1913年间由美国科学家密立根通过著名的“油滴实验”测出的 密立根实验更重要的发现是:电荷是量子化的,即任何带电体所带电荷量只能是e的整数倍 |
各种放射线的性质比较: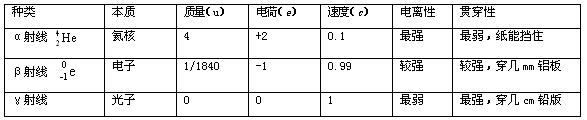
氢原子的能级:
1、氢原子的能级图 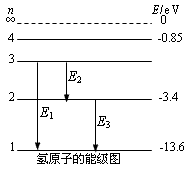
2、光子的发射和吸收
①原子处于基态时最稳定,处于较高能级时会自发地向低能级跃迁,经过一次或几次跃迁到达基态,跃迁时以光子的形式放出能量。
②原子在始末两个能级Em和En(m>n)间跃迁时发射光子的频率为ν,其大小可由下式决定:hυ=Em-En。
③如果原子吸收一定频率的光子,原子得到能量后则从低能级向高能级跃迁。
④原子处于第n能级时,可能观测到的不同波长种类N为:![]() 。
。
⑤原子的能量包括电子的动能和电势能(电势能为电子和原子共有)即:原子的能量En=EKn+EPn。轨道越低,电子的动能越大,但势能更小,原子的能量变小。
电子的动能:![]() ,r越小,EK越大。
,r越小,EK越大。
氢原子的能级及相关物理量:
在氢原子中,电子围绕原子核运动,如将电子的运动看做轨道半径为r的圆周运动,则原子核与电子之间的库仑力提供电子做匀速圆周运动所需的向心力,那么由库仑定律和牛顿第二定律,有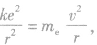 ,则
,则
①电子运动速率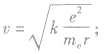
②电子的动能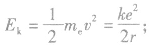
③电子运动周期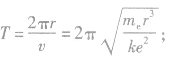
④电子在半径为r的轨道上所具有的电势能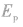
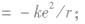
⑤等效电流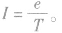 由以上各式可见,电子绕核运动的轨道半径越大,电子的运行速率越小,动能越小,电子运动的周期越大.在各轨道上具有的电视能越大。
由以上各式可见,电子绕核运动的轨道半径越大,电子的运行速率越小,动能越小,电子运动的周期越大.在各轨道上具有的电视能越大。
原子跃迁时光谱线条数的确定方法:
1.直接跃迁与间接跃迁
原子从一种能量状态跃迁到另一种能量状态时,有时可能是直接跃迁,有时可能是间接跃迁,两种情况辐射(或吸收)光子的频率可能不同。
2.一群原子和一个原子
氧原子核外只有一个电子,这个电子在某个时刻只能处在某一个可能的轨道上,在某段时间内,由某一轨道跃迁到另一个轨道时,可能的情况只有一种,但是如果容器中盛有大量的氢原子,这些原子的核外电子跃迁时就会有各种情况出现了。
3.一群氢原子处于量子数为n的激发态时,可能辐射的光谱线条数
如果氢原子处于高能级,对应量子数为n,则就有可能向量子数为(n一1),(n一2),(n一3)…1诸能级跃迁,共可形成(n一1)条谱线,而跃迁至量子数为(n一 1)的氢原子又可向(n一2),(n一3)…1诸能级跃迁,共可形成(n一2)条谱线。同理,还可以形成(n一3),(n 一4)…1条谱线。将以上分析结果归纳求和,则从量子数为n对应的能级向低能级(n—1),(n一2)…1跃迁可形成的谱线总条数为(n一1)+(n一2)+(n一3)+ …+1=n(n一1)/2。数学表示为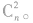
4.一个氢原子处于量子数为n的激发态时,可能辐射的光谱线条数
对于处于量子数为n的一个氢原子,它可能发生直接跃迁,只放出一个光子,也可能先跃迁到某个中间能级上,再跃迁回基态而放出两个光子,也可能逐级跃迁,即先跃迁到n一1能级上,再跃迁到n一2能级上, ……,最后回到基态上,共放出n—1个光子。即一个氢原子在发生能级跃迁时,最少放出一个光子,最多可放出n一1个光子。
利用能量守恒及氢原子能级特征解决跃迁电离等问题的方法:
在原子的跃迁及电离等过程中,总能量仍是守恒的。原子被激发时,原子的始末能级差值等于所吸收的能量,即入射光子的全部能量或者入射粒子的全部或部分能量;原子被电离时,电离能等于原子被电离前所处能级的绝对值,原子所吸收的能量等于原子电离能与电离后电离出的电子的动能之和;辐射时辐射出的光子的能量等于原子的始末能级差。氢原子的能级 F 关系为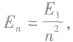 ,第n能级与量子数n2成反比,导致相邻两能级间的能量差不相等,量子数n越大,相邻能级差越小,且第n能级与第n一1能级的差比第n能级与无穷远处的能级差大,即
,第n能级与量子数n2成反比,导致相邻两能级间的能量差不相等,量子数n越大,相邻能级差越小,且第n能级与第n一1能级的差比第n能级与无穷远处的能级差大,即 另外,能级差的大小
另外,能级差的大小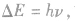 故也可利用光子能量来判定能级差大小。
故也可利用光子能量来判定能级差大小。
跃迁与电离:
激发的方式:
与“电子是组成原子的基本粒子之一。下列对电子的说法中正确的是...”考查相似的试题有:
- (选修3-5选做题)在进行光电效应实验时,用黄光照射某金属表面时发生光电效应现象,并产生了光电流,则[ ]A.若增大黄光的照...
- 如图所示,一束复色光斜射到置于空气中的厚平板玻璃(上、下表面平行)的上表面,穿过玻璃后从下表面射出,变为a、b两束平行...
- 紫光在真空中的波长是4.5×10-7m,(普朗克恒量h=6.63×10-34J·s)问:(1)紫光光子的能量是多少?(2)用它照射极限频率是4.6...
- 1938年哈恩用中子轰击铀核,发现产物中有原子核钡(Ba)、氪(Kr)、中子和一些γ射线。下列关于这个实验的说法正确的是( )A.这...
- 氢原子的核外电子由离原子核较远的轨道跃迁到离核较近的轨道上时,下列说法中正确的是A.氢原子的能量增加B.氢原子的能量减...
- 下图为氢原子能级的示意图,现有大量的氢原子处于n=4的激发态,当向低能级跃迁时辐射出若干不同频率的光,关于这些光下列说法...
- 氢原子的能级如图所示,一群处在n=3的激发态的氢原子向n=1的基态跃迁过程中,下列说法正确的是( )①可能产生的光子有3种②可...
- (选修模块3-5)(1)下列说法中正确的是______A.β衰变现象说明电子是原子核的组成部分B.目前已建成的核电站的能量来自于重...
- (6分)如图为氢原子的能级示意图,锌的逸出功是3.34ev,那么对氢原子在能级跃迁过程中发射或吸收光子的特征认识正确的是 (填...
- 下图为氢原子的能级示意图,一群氢原子处于n=3的激发态,在向较低能级跃迁的过程中向外发出光,下列说法正确的是( )A.从n=...