粗盐提纯:
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+,Mg2+,SO42-等。不溶性杂质可以用过滤的方法除去,可溶性杂质中的Ca2+,Mg2+,SO42-则可通过加入BaCl2、NaOH和Na2CO3溶液,生成沉淀而除去,也可加入BaCO3固体和NaOH溶液来除去。然后蒸发水分得到较纯净的精盐。
粗盐提纯实验:
1. 实验过程:
(1)溶解
(2)在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐。
(3)加入过量BaCl2(去除硫酸根离子)BaCl2+Na2SO4==BaSO4↓+2NaCl
(4)加入过量NaOH(去除镁离子)MgCl2+2NaOH==Mg(OH)2↓+2NaCl
(5)加入过量Na2CO3(去除钙离子及BaCl2中的钡离子)Na2CO3+CaCl2==CaCO3↓+2NaCl
(6)Na2CO3+BaCl2==BaCO3↓+2NaCl
(注:3,4两步可互换。)
(7)过滤
向滤液中加入适量HCl(除去过量NaOH,Na2CO3,可选择用pH试纸控制加入的量,或是直接蒸发)
(8)蒸发结晶
2. 实验步骤:
(1)溶解:
用托盘天平称取5克粗盐(精确到0.1克),用量筒量取10毫升水倒入烧杯里,
用药匙取一匙粗盐加入水中,观察发生的现象,用玻璃棒搅拌,并观察发生的现象。
接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止,观察溶液是否浑浊。
(2)过滤:
将滤纸折叠后用水润湿使其紧贴漏斗内壁并使滤纸上沿低于漏斗口,溶液液面低于滤纸上沿,
倾倒液体的烧杯口要紧靠玻璃棒,玻璃棒的末端紧靠有三层滤纸的一边,漏斗末端紧靠承接
滤液的烧杯的内壁。慢慢倾倒液体,待滤纸内无水时,仔细观察滤纸上的剩余物及滤液的颜色,
滤液仍浑浊时,应该再过滤一次。
(3)蒸发:
把得到的澄清滤液倒入蒸发皿,把蒸发皿放在铁架台的铁圈上,用酒精灯加热同时用玻璃棒
不断搅拌滤液,等到蒸发皿中出现较多量固体时,停止加热,利用蒸发皿的余热使滤液蒸干。
(4)用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器,比较提纯前后食盐的状态
并计算精盐的产率。
(5)去除可溶性杂质:溶解,依次加入过BaCl2,NaOH,Na2CO3过滤。向滤液中加入适量HCl,
蒸发,结晶。
产率计算:
将提纯后的氯化钠与粗盐作比较,计算精盐的产率。
(误差分析:明显偏低:A.溶解时将粗盐一次全部倒入水中,立即过滤B.蒸发时,有一些液体、固体溅出。
偏高:提纯后的精盐尚未完全干燥就称其质量.粗盐中含有其他可溶性固体。)
元素变化:
反应前:NaCl、MgCl2、CaCl2、Na2SO4
加入BaCl2(过量)产生BaSO4沉淀溶液内还剩:NaCl、MgCl2、CaCl2、BaCl2
加入Na2CO3(过量)产生CaCO3沉淀和BaCO3沉淀溶液内还剩:NaCl、MgCl2、Na2CO3
加入NaOH(过量)产生Mg(OH)2沉淀溶液内还剩:NaCl、Na2CO3、NaOH
加入HCl(过量)产生CO2、H2O溶液内还剩:HCl、NaCl
蒸发后:NaCl
实验现象:
溶解:粗盐固体为灰色,加入水中所得液体呈浑浊状。
过滤:滤液是无色透明液体,滤纸上的残留物呈黑色。
蒸发:随着加热,蒸发皿中液体的量减少;当蒸发到一定程度时,蒸发皿底部有固体析出。蒸发得到的固体为白色。
过程中玻璃棒的作用:
(1)溶解时:搅拌,加速溶解
(2)过滤时:引流
(3)蒸发时:搅拌,使液体均匀受热,防止液体飞溅
水蒸气的检验方法:
用无水硫酸铜,如无水硫酸铜由白色变为蓝色,则说明有水存在。
空气检验方法:
用燃着的木条,如果木条燃烧一会后熄灭,则证明有空气的存在。
物质的相互转化和制备:
主要是指以氧气、氢气、碳、硫、磷等为代表的非金属单质,以铝、镁、锌、铁、铜为代表的金属单质,以一氧化碳、二氧化碳等为代表的非金属氧化物,以氧化铜、氧化铁等为代表的金属氧化物,以盐酸、硫酸、碳酸等为代表的酸,以氢氧化钠、氢氧化钙等为代表的碱,以氯化钠、碳酸钠、碳酸氢钠、碳酸钙等为代表的盐,等等物质之间的相互和制备.
物质的相互转化:
氢氧化钠与氢氧化钙的制备: (1)NaOH的制备
方法一:Na
2O+H
2O==2NaOH
方法二:Na
2CO
3+Ca(OH)
2==CaCO
3↓ +2NaOH
(2)Ca(OH)
2的制备方法:CaO+H2O==Ca(OH)
2
常见物质的相互转化: Na→Na
2O→NaOH→Na
2CO
3 C→CO→CO
2→H
2CO
3 Fe→Fe
2O
3→Fe
2(SO
4)
3→Fe(OH)
3→FeCl
3 S→SO
2→SO
3→H
2SO
4(单质硫不能直接转化为SO
3)
各类物质间的转化关系: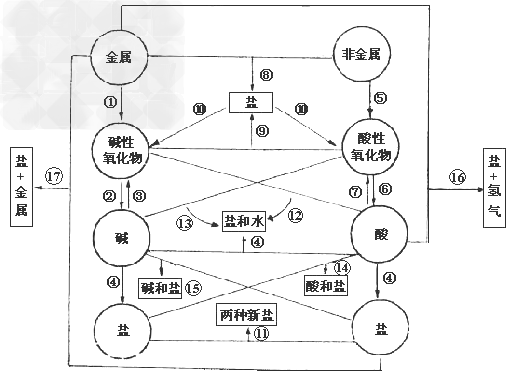
(1)金属+

金属氧化物(碱性氧化物)

(2)碱性氧化物(可溶)+水

碱(可溶)
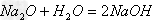
(3)碱(难溶)
碱氧(难溶)+水
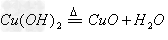
(4)酸+碱
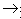
盐+水
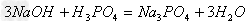
;
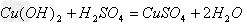
(5)非金属+
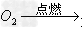
非金属氧化物(酸性氧化物)
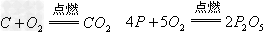
(6)酸性氧化物(易溶)+水
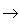
酸(易溶)
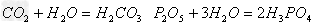
(7)酸(易挥发/难溶)

酸氧+水(易挥发/难溶)

从纵向来看,金属
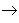
碱性氧化物
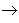
碱
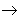
盐,其中金属元素相同。
非金属
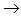
酸性氧化物
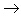
酸(含氧酸)

盐,其中非金属元素相同。
横向:
(8)金属+非金属(无氧酸)
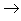
盐
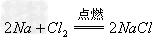
(9)碱氧+酸氧(含氧酸)
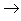
盐
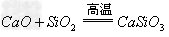
(10)含氧酸盐
碱氧+酸氧
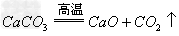
(11)盐+盐

两种新盐
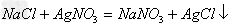
交叉:
(12)酸+碱氧
盐+水

(13)碱+酸氧
盐+水
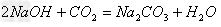
(14)酸+盐
新酸+新盐

;
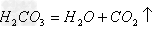
(15)碱+盐
新碱+新盐

(16)金属+酸
盐+
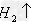
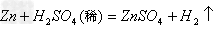
(17)金属+盐
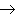
新盐+新金属
(18)金属+盐
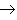
新盐+新金属

(置换反应)