本试题 “小丽在观察课本实验“燃烧的条件”(左图)时,经查阅资料知产生的大量白烟对人体健康有影响,于是对此实验进行改进(右图),将足量的红磷和白磷分别放于两个...” 主要考查您对空气中氧气含量的测定
验证物质燃烧的条件
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 空气中氧气含量的测定
- 验证物质燃烧的条件
空气中氧气含量的测定实验是初中化学的一个重要实验,同时也是历年各地中考命题的热点。近年来在课本实验的基础上进行拓展、创新,旨在考查同学们的实验探究能力及创新思维能力已成为中考命题的趋势。
空气中氧气含量的测定实验:
| 原理 | 利用红磷在空气中燃烧,将瓶内氧气消耗掉,生成五氧化二磷固体,使空气内压强减少,在大气压作用下,进入容器内水的体积即为减少的氧气的体积。4P + 5O2 2P2O5 2P2O5 |
| 装置 | 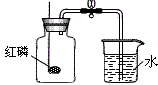 |
| 步骤 | ①连接装置,检查装置气密性 ②把集气瓶的容积分成5等份,做好记号。 ③用止水夹夹紧胶管。 ④在燃烧匙内放入过量的红磷。 ⑤点燃燃烧匙中的红磷,立即伸入集气瓶中,把塞子塞紧 ⑥待红磷熄灭并冷却后,打开止水阀 |
| 现象 | ①集气瓶中有大量的白烟生成,并放出热量 ②打开止水夹,烧杯中的水倒流到集气瓶中,并上升到约1/5处 |
| 结论 | 空气中氧气的体积分数约为1/5。 |
实验中的注意事项:
1.测定空气中氧气的体积分数时,所用物质应满足的条件:
①此物质能够在空气中中燃烧,不能用铁丝代替,铁丝在空气中不能燃烧
②此物质在空气中燃烧的时只能消耗氧气,不能消耗其他气体。不能选用镁代替红磷,因为镁不仅与空气中的氧气反应,还和二氧化碳反应。
③此物质在空气中燃烧时只能生成固体,而不能生成气体,一般不用木炭,硫代替红磷。
2.实验失败与成功的原因:
①装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性。如果气密性不好,外界空气会进入容器,使测定结果低于1/5。
②实验中红磷要过量,以消耗容器内全部氧气,否则会使测定结果低于1/5.
③实验完毕,待容器冷却至室温后,再打开止水夹,观察进水的体积,避免因温度高,气体膨胀,使测定结果低于1/5.
空气中氧气含量测定实验的改进:
1.测定原理:
(1)红磷(白磷)在密闭的容器中燃烧,消耗氧气,生成白色固体五氧化二磷。密闭容器内压强减小,大气压将水压入容器,通过测定容器中的水的量测定氧气在空气中的含量。
(2)利用金属与氧气反应,消耗密闭容器中的氧气使密闭容器内压强减小,在大气压的作用下,推动刻度器上的活塞移动,测出氧气体积。
2.装置
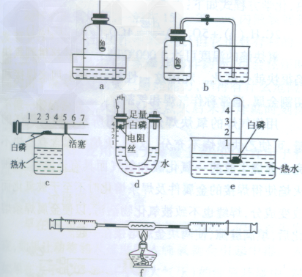
3.实验现象
(1)红磷(白磷)燃烧,产生大量白烟
(2)a中睡眠上升约占钟罩内空气体积的1/5
b中进入集气瓶中水的体积约占集气瓶液面以上容积的1/5
c中活塞移动到4处
d中U形管左侧液面上升至刻度1处
e中试管中液面上升至刻度1处
f中右侧的活塞会左移
4.结论
空气中氧气体积约占空气总体积的1/5
5.注意事项
(1)实验中红磷要过量,以消耗容器内全部氧气,否则会使测定结果低于1/5.
(2)装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性。如果气密性不好,外界空气会进入容器,使测定结果低于1/5。
(3)不能用硫、木炭、铁丝等代替红磷(白磷)。因为硫或木炭燃烧后产生的气体会弥补反应所消耗的氧气,导致测得的体积不准确,而细铁丝在空气中难以燃烧,氧气体积几乎不变,因此密闭空气内水面不上升。
(4)导气管要夹紧,燃烧匙放入集气瓶时要迅速,防止空气受热膨胀,从导气管或集气瓶逸出,导致进入水的体积增多,使实验结果偏高。
定义:
燃烧是一种发光、发热的剧烈的化学反应。认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
燃烧条件的探究实验:
1. 实验方案
2. 实验结论:
燃烧必须同时具备:
①可燃物
②氧气(空气)
③达到燃烧所需的最低温度(着火点)
1. 着火点:可燃物燃烧所需的最低温度叫着火点,是物质固有的一种性质,与物质本身的性质有关,一般不随外界条件的改变而改变。
在通常状况下一些常见物质的着火点
2. 探究燃烧条件的实验设计方法
燃烧必须同时具备: ①可燃物 ②氧气(空气) ③达到燃烧所需的最低温度(着火点)。中考试题往往以实验设计题的形式来考查燃烧规律。燃烧条件的探究设计常常运用控制变量—对比法。
(1)分析对比实验设计

实验1:探究可燃物才能燃烧
实验2:探究可燃物接触氧气才能燃烧
实验3:探究达到着火点可燃物才能燃烧
(2)综合控制变量
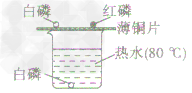
①把白磷和红磷都漏置在空气中(对比),用0℃的热水控制温度(这个温度高于白磷的着火点,低于红磷的着火点),白磷能燃烧,红磷不能燃烧,证明可燃物与氧气接触,且可燃物还必须达到着火点才能燃烧。
②烧杯底部放一块白磷,用水控制不让白磷与空气接触,温度仍然是80℃,与铜片上的白磷对比,证明可燃物即使温度达到着火点,如果不与氧气接触也不能燃烧。
燃烧是一种发光、发热的剧烈的化学反应。认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
燃烧条件的探究实验:
1. 实验方案
| 实验方案 | 实验现象 | 分析 |
分别将一小块白磷和一小块红磷放在薄铜片上,另取一小块白磷放入热水中,如下图: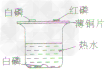 |
①薄铜片上:白磷燃烧,产生大量白烟,红磷没有变化 ②热水中,白磷没有燃烧 |
①白磷、红磷都是可燃物.薄铜片上的白磷与O2接触,同时温度达到白磷的着火点,故白磷能够燃烧 ②薄铜片上的红磷与O2 接触,但温度没有达到其着火点,热水中的白磷温度达到了其着火点.但没有与O2接触,所以红磷和水中的白磷都不能燃烧 |
2. 实验结论:
燃烧必须同时具备:
①可燃物
②氧气(空气)
③达到燃烧所需的最低温度(着火点)
1. 着火点:可燃物燃烧所需的最低温度叫着火点,是物质固有的一种性质,与物质本身的性质有关,一般不随外界条件的改变而改变。
在通常状况下一些常见物质的着火点
| 物质 | 白磷 | 红磷 | 木材 | 木炭 | 无烟煤 |
| 着火点/℃ | 40 | 240 | 250-330 | 320-370 | 700-750 |
燃烧必须同时具备: ①可燃物 ②氧气(空气) ③达到燃烧所需的最低温度(着火点)。中考试题往往以实验设计题的形式来考查燃烧规律。燃烧条件的探究设计常常运用控制变量—对比法。
(1)分析对比实验设计

实验1:探究可燃物才能燃烧
实验2:探究可燃物接触氧气才能燃烧
实验3:探究达到着火点可燃物才能燃烧
(2)综合控制变量

①把白磷和红磷都漏置在空气中(对比),用0℃的热水控制温度(这个温度高于白磷的着火点,低于红磷的着火点),白磷能燃烧,红磷不能燃烧,证明可燃物与氧气接触,且可燃物还必须达到着火点才能燃烧。
②烧杯底部放一块白磷,用水控制不让白磷与空气接触,温度仍然是80℃,与铜片上的白磷对比,证明可燃物即使温度达到着火点,如果不与氧气接触也不能燃烧。
发现相似题
与“小丽在观察课本实验“燃烧的条件”(左图)时,经查阅资料知产...”考查相似的试题有:
- 如图所示,在测定空气中氧气体积含量的实验中,某兴趣小组测得进入集气瓶内水的体积大于其容积的1/5,其原因可能是A.红磷的...
- 从下图获取的信息中错误的是A.空气是一种混合物B.该过程为物理变化C.氮气沸点比氧气高D.氧气由氧分子构成
- 我们已经知道空气的主要成分是氮气和氧气,如图所示为测定空气中氧气含量的实验示意图。(1)实验中,燃烧匙里为什么要盛过量...
- 下列关于空气的说法可,错误的是:A.空气可的稀有气体一般不跟其它物质反应,曾被称为“惰性气体”。B.按质量计算,空气可约...
- 吴江市某日的空气质量日报如下表:项目空气污染指数空气质量级别空气质量可吸入颗粒物65Ⅱ良二氧化硫6二氧化氮20下列情况对表中...
- 为探究物质燃烧条件,某同学做了如下图所示实验:已知白磷着火点40℃,红磷着火点240℃;发现水中白磷和铜片上红磷 都没燃烧,...
- 把几小块木炭放在球形管中,按下图所示连接装置。打开玻璃活塞,氧气进入球形管,发现木炭不燃烧;关掉氧气,给球形管内木炭...
- 下列做法正确的是A.用铝锅盛放酸性食物B.菜刀使用后放在潮湿的砧板上C.用水浇灭锅中着火的油D.天然气泄漏应该及时的开窗...
- 下列气体与空气混合后遇明火,可能发生爆炸的是A.氧气B.氮气C.氢气D.二氧化碳
- 根据燃烧三角图,请你设计三种不同类的方法使一根点燃的蜡烛熄灭,并简述熄灭的原因.(6分)序号方案灭火原理1 2 3