本试题 “如图是密闭体系中某反应的微观示意图,“”和“”分别表示不同原子.请用下列粒子的字母序号回答(1)、(2)两个小题:A.B.C.(1)依据质量守恒定律,反应后...” 主要考查您对质量守恒定律
化学反应方程式的书写
文字表达式
化学反应微观示意图
分子的定义
原子的定义
单质和化合物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 质量守恒定律
- 化学反应方程式的书写
- 文字表达式
- 化学反应微观示意图
- 分子的定义
- 原子的定义
- 单质和化合物
质量守恒定律的概念及对概念的理解:
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。
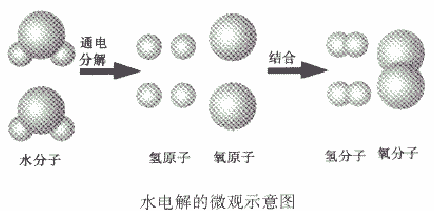
质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。

质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
| 六个不变 | 宏观 | 反应前后的总质量不变 |
| 元素的种类不变 | ||
| 元素的质量不变 | ||
| 微观 | 原子的种类不变 | |
| 原子的数目不变 | ||
| 原子的质量不变 |
| 两个一定变 | 物质的种类一定变 |
| 构成物质的分子种类一定变 |
| 两个可能变 | 分子的总数可能变 |
| 元素的化合价可能变 |
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
概念:用文字表示化学反应的式子
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
化学反应的本质:
化学反应的本质是原子的重新组合。化学反应围观示意图能清晰的使用微观粒子表示化学反应的本质和过程。
例如:

表示的化学反应为:Cl2+2NaClO2==2NaCl+2ClO2
典型例题解析:
一、确定模型表示的物质
例1:分子模型可以直观的表示分子的微观结构(分子模型中,不同颜色、大小的小球代表不同的原子)。下图所示的分子模型表示的分子是

A.HCHO B.CO2 C.NH3 D.CH4
【解析】:模型表示物质的确定要从物质的元素种类、每个分子中原子的个数、原子的总数来综合考虑。模型中小球的大小及颜色不同值代表了不同种类的原子,也就是代表了宏观上的元素种类的不同。同种小球的个数代表了同种原子的个数。本题中有三种不同的小球,说明分子中有三种不同的原子,且其中有两个同种原子,另外分别有两种一个原子。符合条件的只有A。
【答案】:A。
二、判定模型表示的变化
例2:下列用微观图示表示的物质变化,属于化学变化的是
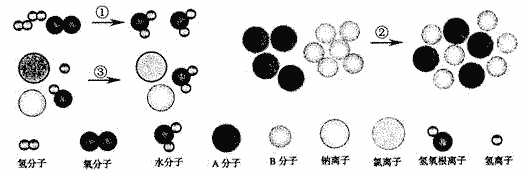
A.①②B.②③C.①③D.①②③
【解析】:化学变化的判定标准就是要有新物质生成。在三个变化中,①表示了氢气和氧气反应生成水的反应,有新物质水生成,化学变化。②中变化前是A、B两种物质,变化后仍然是这两种物质,没有新物质生成,物理变化。③反应前有钠离子、氯离子、氢离子和氢氧根离子,反应后氢离子和氢氧根离子生成了水,有新物质生成,化学变化。
【答案】:C。
三、观察模型变化的结果
例3:右图表示封闭在某容器中的少量液态水的微观示意图(该容器的活塞可以左右移动)。煮沸后,液态水变成水蒸气。在这一过程中,发生的变化是( )
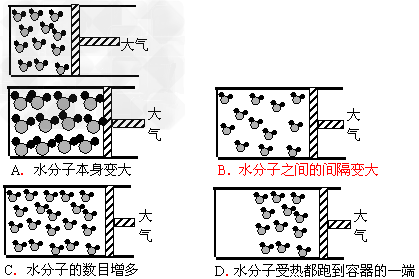
【解析】:水受热由液态变成水蒸气是物理变化,根据物理变化的定义,变化前后物质不变,水分子的本身大小和个数也不会改变,仅仅是分子间的间隔变大,且分子还是均一的状态,不会跑到容器的一端。
【答案】:B。
四、判定模型表示的化学反应类型
例4:如图所示的微观化学变化的反应类型是
A.置换反应 B.化合反应 C.分解反应 D.复分解反应
【解析】:观察反应前后模型的变化,可以知道:反应前只有一种化合物,反应后生成了一种化合物和一种单质,符合一分为多这样的特征,应该是分解反应。
【答案】:C。
五、判定模型表示的物质分类
例5:物质都是由微粒构成的。若用“○”和“●”表示两种不同元素的原子,下列能表示化合物的是
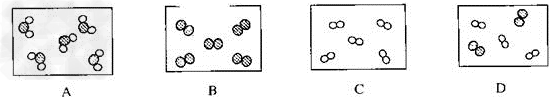
【解析】:物质的分类要熟悉:按照物质种类分为混合物和纯净物;纯净物按照元素种类分为单质和化合物;化合物按照元素的性质分成酸、碱、盐、氧化物。判定物质的分类主要看模型中原子的种类和原子结合成的集团的种类,前者代表了元素的种类,后者代表了物质的种类。本题中A中每个集团中有两种原子,且整个中只有一种这样的集团,所以它是化合物,B和C都是由同种原子构成的一个集团,属于单质,D是B和C那样的两种单质组成的混合物。
【答案】:A。
六、判定模型表示的粒子构成
例6:参考下列物质的微观结构图示,其中由阴,阳离子构成的物质是()
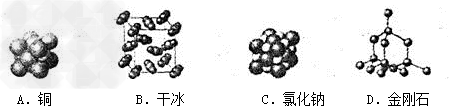
【解析】:组成物质的粒子有三种:分子、原子、离子。铜属于金属,是由原子构成。干冰是二氧化碳的固体,由分子构成。氯化钠是由阳离子钠离子和阴离子氯离子构成。金刚石由原子构成。
【答案】:C。
七、安排化学反应顺序
例7:水电解的过程可用下列图示表示,微粒运动变化的先后顺序是
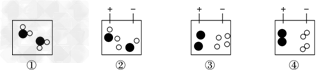
A.①②③④ B.④①③② C.①②④③ D.①④③②
【解析】:水电解是水在直流电的作用下分解成氢气和氧气的过程,属于化学变化。它的过程应该是:水分子先在直流电的作用下分解成氢原子和氧原子,随后后氢原子向负极移动,氧原子向正极移动,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子,最后大量氢分子聚集在负极,大量氧分子聚集在正极,且体积比为2:1。
【答案】:A。
八、寻找符合模型的化学反应
例8:下图是用比例模型来表示物质间发生化学反应的微观示意图。图中“ ”分别表示两种元素的原子,一定条件下发生的下列反应能用下图表示的是
”分别表示两种元素的原子,一定条件下发生的下列反应能用下图表示的是
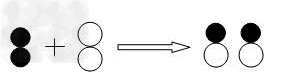
A.2H2+O2=2H2O B.2CO+O2=2CO2 C.N2+O2=2NO D.N2+3H2=2NH3
【解析】:如果简单的判定反应前有两种物质,反应后有一种物质,是化合反应,那这个题仍然没有答案。再进一步判定反应前是两种单质,仍然有ACD三个答案。其实微观模型除了告诉物质种类外,还表示了反应前后粒子的个数关系,这是根据模型寻找化学反应的重要依据。本题中反应前后两种双原子单质与生成的化合物的个数比是1;1;2.符合这个关系的方程式只有C。
【答案】:C。
九、找寻化学反应的微观模型
例9:氢气不仅可以在空气中燃烧,还可以在氯气中燃烧,反应方程式为H2+Cl2 2HCl,若用“○”表示氯原子,“●”表示氢原子,则上述反应可表示为
2HCl,若用“○”表示氯原子,“●”表示氢原子,则上述反应可表示为
A.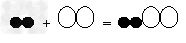
B.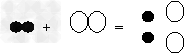
C.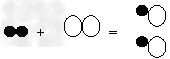
D.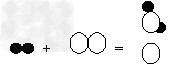
【解析】:知道了化学方程式,就知道了反应物、生成物和它们的数量关系。此题反应前都是一个氢分子和一个氯分子,没有差别,因此要看生成物。由反应知道生成物应该是HCl,它是由一个氢和一个氯原子构成,且每一个氢分子、一个氯分子要生成两个HCl分子。正确表了生成物是氯化氢,数量比是1:1:2的就只有C。
【答案】:C。
十、比较模型微粒的质量和半径
例10:微粒模型观察与比较。如下图所示,在钠与氯气的反应中,每个钠原子失去1个电子,成为1个钠离子;每个氯原子得到1个电子,成为1个氯离子;钠离子与氯离子结合、形成氯化钠。因为1个电子的质量大约为1个质子或中子质量的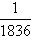 ,故原子的质量几乎都集中在原子核上。若用r、m分别表示微粒的半径和质量,以“<”或“>”或“≈”填空。
,故原子的质量几乎都集中在原子核上。若用r、m分别表示微粒的半径和质量,以“<”或“>”或“≈”填空。
(1)m(Na)____m(Na+);(2)r(Cl)___r(Cl-); (3)r(Na)___r(Cl);(4)r(Na+)_____r(Cl-)。

【解析】:此题形式新颖,别致有趣。考查的是学生分析问题和观察图形的能力。由材料可知:电子质量所占很小,得失对原子影响很小。那么钠原子和失去一个电子的钠离子的质量就几乎相等。半径要看清模型:氯原子的半径小于氯离子半径,钠原子半径大于氯原子半径,钠离子半径小于氯离子半径。
【答案】:≈;<;>;<
十一、说明模型图示的微观意义
例11:某化学反应的微观示意图如下,图中“ ”“
”“ ”,
”,
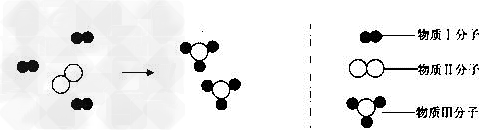
下列说法不正确的是()
A.每3g物质Ⅰ与1g物质Ⅱ恰好完全反应生成2g物质Ⅲ
B.每3个物质Ⅰ分子与1个物质Il分子恰好完全反应生成2个物质Ⅲ分子
C.每3万个物质Ⅰ分子与1万个物质Ⅱ分子恰好完全反应生成2万个物质Ⅲ分子
D.每3n个物质Ⅰ分子与n个物质Ⅱ分子恰好完全反应生成2n个物质Ⅲ分
【解析】:一个表示化学反应的微观示意图,除了能分析出反应物、生成物的种类外,还能知道反应物、生成物的粒子个数比。由图示可知:物质Ⅰ、物质Il分子、物质Ⅲ分子个数比是3:1:2。只有符合这个结果的微粒数量都可以,所以BCD正确。A错误的把粒子个数比等同于质量比,实际上质量还和每种物质的相对分子质量有关系。
【答案】:A。
十二、确定模型图示的构成
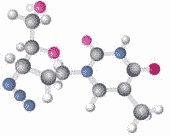
例12:蛋白质是人类重要的营养物质,它是由多种氨基酸构成的化合物,丙氨酸是其中的一种。下列有关丙氨酸的叙述正确的是( )

A.丙氨酸是由四种原子构成
B.一个丙氨酸分子中质子数是89
C.丙氨酸中氮元素与氢元素的质量比为2:1
D.丙氨酸的化学式为C3H6O2N
【解析】:细致的观察和准确的记数以及科学的叙述是重要的科学素养,也是中考的出发点和归宿。本题就是这样的一个好题。丙氨酸分子中的确有氢、碳、氧、氮四种原子,但正确的说法是丙氨酸是由丙氨酸分子构成,每个丙氨酸分子由四种原子构成。看图可知丙氨酸分子的化学式应该是C3H7O2N,一个丙氨酸分子中质子数是各个原子中子数之和,应该是44,丙氨酸中氮元素与氢元素的质量比为14:7就是2:1。
【答案】:C。
十三、计算质量、质量比
例13:A物质常用于焊接或切割金属。把一定质量的纯净物A和40g的纯净物B在—定条件下按下图所示充分反应,当B物质反应完时,可生成44gC物质和9gD物质。
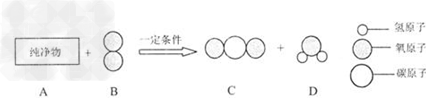
①参加反应的A物质的质量是_____________。
②A物质中各元素的质量比为_____________。
【解析】:由模型可知:反应生成的C是二氧化碳,D是水,由生成44g二氧化碳可计算出反应前有碳元素的质量是12g,氧元素质量是32g,9g可计算出氢元素质量是1g,氧元素质量是8g。A的质量是44g+9g—40g=13g,A物质中有12g碳,1g氢。碳、氢元素质量比是12:1。
【答案】: ①参加反应的A物质的质量是13g ②A物质中碳、氢元素质量比是12:1。
十四、化学反应模型图示的规律或结论
例14:右图是氧化汞分子分解示意图。从示意图中,你能够得出的规律或者结论有:(答出两条即可)

(1)________________。(2)_________________。
【解析】:化学反应的模型就是表示了一个化学反应的进行过程,所以只要和这个反应有关的信息都可以作为它的结论,特别是化学方程式的意义,化学变化的实质是其重要的部分。如化学反应有新物质生成,化学变化分子种类要变,原子种类不变,化学反应前后原子质量数目不变,每两个氧化汞分子分解生成一个氧分子和两个汞原子等。本题是开放性题,只要合理均可。
【答案】:⑴原子是化学变化中的最小粒子。⑵在化学反应前后,原子数目没有增减。
十五、完成模型、写出反应
例15:下图是密闭体系中某反应的微观示意图,“○”和“●”分别表示不同原子。
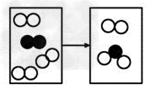
(1)反应后方框内应再填入1个微粒(选填序号)。 A.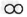 B.
B. C.
C.
(2)该反应所属的基本反应类型是__________反应。
(3)写出符合该微观示意图的一个具体反应的化学方程式______________________。
【解析】:在密闭体系中反应前后原子种类,个数均不变。反应有三个 分子,反应后剩余一个,则反应了两个,反应前有一个
分子,反应后剩余一个,则反应了两个,反应前有一个 分子,反应后没有,则参加了反应,反应后应该生成了两个
分子,反应后没有,则参加了反应,反应后应该生成了两个 分子,所以应再填一个
分子,所以应再填一个 。反应两种物质生成一种物质,化合反应。注意没有反应的不要影响思维,当成了两种生成物。要写符合图示的反应,就要能总结出反应的特点:反应物是两种双原子分子,单质,这样的物质一般是气体,生成物是一种化合物,且个数比是1:2:2。在初中化学中比较熟悉的就是氢气燃烧。
。反应两种物质生成一种物质,化合反应。注意没有反应的不要影响思维,当成了两种生成物。要写符合图示的反应,就要能总结出反应的特点:反应物是两种双原子分子,单质,这样的物质一般是气体,生成物是一种化合物,且个数比是1:2:2。在初中化学中比较熟悉的就是氢气燃烧。
【答案】:(1)C(2)化合(3)2H2+O2 2H2O
2H2O
解题方法点拨:
要想解答好这类题目,首先,要理解和熟记微粒观点及模型图的应用,以及与之相关的知识。然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生产或生活经验所得,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。同时,还要注意以下几点:
1.运用微粒观点解释实际问题时,要先看看与哪种粒子有关,然后再联系着该粒子的有关性质进行分析解答之。
2.运用模型图来解答有关题目时,要先留意单个原子模型图的说明(即原子模型图所代表的意义和相应的元素符号),然后再逐一分析,综合考虑。尤其是,在解答用模型图来表示化学反应的题目时,一定要特别细心地进行全面思考才行;一般要做到以下“六抓”:
⑴抓分子、原子的性质,分子、原子都是构成物质的微粒;
⑵抓在化学反应中分子可分成原子,原子不能再分,但原子能重新组合成新的分子;
⑶抓分子是由原子构成的;
⑷抓化学反应前后原子的种类、数目不变;
⑸抓反应基本类型及反应物、生成物的类别;
⑹抓单个分子的构成情况;等等。
化学反应的本质是原子的重新组合。化学反应围观示意图能清晰的使用微观粒子表示化学反应的本质和过程。
例如:

表示的化学反应为:Cl2+2NaClO2==2NaCl+2ClO2
典型例题解析:
一、确定模型表示的物质
例1:分子模型可以直观的表示分子的微观结构(分子模型中,不同颜色、大小的小球代表不同的原子)。下图所示的分子模型表示的分子是

A.HCHO B.CO2 C.NH3 D.CH4
【解析】:模型表示物质的确定要从物质的元素种类、每个分子中原子的个数、原子的总数来综合考虑。模型中小球的大小及颜色不同值代表了不同种类的原子,也就是代表了宏观上的元素种类的不同。同种小球的个数代表了同种原子的个数。本题中有三种不同的小球,说明分子中有三种不同的原子,且其中有两个同种原子,另外分别有两种一个原子。符合条件的只有A。
【答案】:A。
二、判定模型表示的变化
例2:下列用微观图示表示的物质变化,属于化学变化的是

A.①②B.②③C.①③D.①②③
【解析】:化学变化的判定标准就是要有新物质生成。在三个变化中,①表示了氢气和氧气反应生成水的反应,有新物质水生成,化学变化。②中变化前是A、B两种物质,变化后仍然是这两种物质,没有新物质生成,物理变化。③反应前有钠离子、氯离子、氢离子和氢氧根离子,反应后氢离子和氢氧根离子生成了水,有新物质生成,化学变化。
【答案】:C。
三、观察模型变化的结果
例3:右图表示封闭在某容器中的少量液态水的微观示意图(该容器的活塞可以左右移动)。煮沸后,液态水变成水蒸气。在这一过程中,发生的变化是( )

【解析】:水受热由液态变成水蒸气是物理变化,根据物理变化的定义,变化前后物质不变,水分子的本身大小和个数也不会改变,仅仅是分子间的间隔变大,且分子还是均一的状态,不会跑到容器的一端。
【答案】:B。
四、判定模型表示的化学反应类型
例4:如图所示的微观化学变化的反应类型是

A.置换反应 B.化合反应 C.分解反应 D.复分解反应
【解析】:观察反应前后模型的变化,可以知道:反应前只有一种化合物,反应后生成了一种化合物和一种单质,符合一分为多这样的特征,应该是分解反应。
【答案】:C。
五、判定模型表示的物质分类
例5:物质都是由微粒构成的。若用“○”和“●”表示两种不同元素的原子,下列能表示化合物的是

【解析】:物质的分类要熟悉:按照物质种类分为混合物和纯净物;纯净物按照元素种类分为单质和化合物;化合物按照元素的性质分成酸、碱、盐、氧化物。判定物质的分类主要看模型中原子的种类和原子结合成的集团的种类,前者代表了元素的种类,后者代表了物质的种类。本题中A中每个集团中有两种原子,且整个中只有一种这样的集团,所以它是化合物,B和C都是由同种原子构成的一个集团,属于单质,D是B和C那样的两种单质组成的混合物。
【答案】:A。
六、判定模型表示的粒子构成
例6:参考下列物质的微观结构图示,其中由阴,阳离子构成的物质是()

【解析】:组成物质的粒子有三种:分子、原子、离子。铜属于金属,是由原子构成。干冰是二氧化碳的固体,由分子构成。氯化钠是由阳离子钠离子和阴离子氯离子构成。金刚石由原子构成。
【答案】:C。
七、安排化学反应顺序
例7:水电解的过程可用下列图示表示,微粒运动变化的先后顺序是

A.①②③④ B.④①③② C.①②④③ D.①④③②
【解析】:水电解是水在直流电的作用下分解成氢气和氧气的过程,属于化学变化。它的过程应该是:水分子先在直流电的作用下分解成氢原子和氧原子,随后后氢原子向负极移动,氧原子向正极移动,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子,最后大量氢分子聚集在负极,大量氧分子聚集在正极,且体积比为2:1。
【答案】:A。
八、寻找符合模型的化学反应
例8:下图是用比例模型来表示物质间发生化学反应的微观示意图。图中“
 ”分别表示两种元素的原子,一定条件下发生的下列反应能用下图表示的是
”分别表示两种元素的原子,一定条件下发生的下列反应能用下图表示的是 
A.2H2+O2=2H2O B.2CO+O2=2CO2 C.N2+O2=2NO D.N2+3H2=2NH3
【解析】:如果简单的判定反应前有两种物质,反应后有一种物质,是化合反应,那这个题仍然没有答案。再进一步判定反应前是两种单质,仍然有ACD三个答案。其实微观模型除了告诉物质种类外,还表示了反应前后粒子的个数关系,这是根据模型寻找化学反应的重要依据。本题中反应前后两种双原子单质与生成的化合物的个数比是1;1;2.符合这个关系的方程式只有C。
【答案】:C。
九、找寻化学反应的微观模型
例9:氢气不仅可以在空气中燃烧,还可以在氯气中燃烧,反应方程式为H2+Cl2
 2HCl,若用“○”表示氯原子,“●”表示氢原子,则上述反应可表示为
2HCl,若用“○”表示氯原子,“●”表示氢原子,则上述反应可表示为 A.
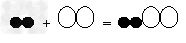
B.
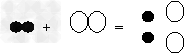
C.
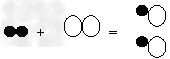
D.
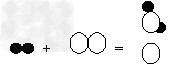
【解析】:知道了化学方程式,就知道了反应物、生成物和它们的数量关系。此题反应前都是一个氢分子和一个氯分子,没有差别,因此要看生成物。由反应知道生成物应该是HCl,它是由一个氢和一个氯原子构成,且每一个氢分子、一个氯分子要生成两个HCl分子。正确表了生成物是氯化氢,数量比是1:1:2的就只有C。
【答案】:C。
十、比较模型微粒的质量和半径
例10:微粒模型观察与比较。如下图所示,在钠与氯气的反应中,每个钠原子失去1个电子,成为1个钠离子;每个氯原子得到1个电子,成为1个氯离子;钠离子与氯离子结合、形成氯化钠。因为1个电子的质量大约为1个质子或中子质量的
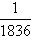 ,故原子的质量几乎都集中在原子核上。若用r、m分别表示微粒的半径和质量,以“<”或“>”或“≈”填空。
,故原子的质量几乎都集中在原子核上。若用r、m分别表示微粒的半径和质量,以“<”或“>”或“≈”填空。(1)m(Na)____m(Na+);(2)r(Cl)___r(Cl-); (3)r(Na)___r(Cl);(4)r(Na+)_____r(Cl-)。

【解析】:此题形式新颖,别致有趣。考查的是学生分析问题和观察图形的能力。由材料可知:电子质量所占很小,得失对原子影响很小。那么钠原子和失去一个电子的钠离子的质量就几乎相等。半径要看清模型:氯原子的半径小于氯离子半径,钠原子半径大于氯原子半径,钠离子半径小于氯离子半径。
【答案】:≈;<;>;<
十一、说明模型图示的微观意义
例11:某化学反应的微观示意图如下,图中“
 ”“
”“ ”,
”,
下列说法不正确的是()
A.每3g物质Ⅰ与1g物质Ⅱ恰好完全反应生成2g物质Ⅲ
B.每3个物质Ⅰ分子与1个物质Il分子恰好完全反应生成2个物质Ⅲ分子
C.每3万个物质Ⅰ分子与1万个物质Ⅱ分子恰好完全反应生成2万个物质Ⅲ分子
D.每3n个物质Ⅰ分子与n个物质Ⅱ分子恰好完全反应生成2n个物质Ⅲ分
【解析】:一个表示化学反应的微观示意图,除了能分析出反应物、生成物的种类外,还能知道反应物、生成物的粒子个数比。由图示可知:物质Ⅰ、物质Il分子、物质Ⅲ分子个数比是3:1:2。只有符合这个结果的微粒数量都可以,所以BCD正确。A错误的把粒子个数比等同于质量比,实际上质量还和每种物质的相对分子质量有关系。
【答案】:A。
十二、确定模型图示的构成
例12:蛋白质是人类重要的营养物质,它是由多种氨基酸构成的化合物,丙氨酸是其中的一种。下列有关丙氨酸的叙述正确的是( )

A.丙氨酸是由四种原子构成
B.一个丙氨酸分子中质子数是89
C.丙氨酸中氮元素与氢元素的质量比为2:1
D.丙氨酸的化学式为C3H6O2N
【解析】:细致的观察和准确的记数以及科学的叙述是重要的科学素养,也是中考的出发点和归宿。本题就是这样的一个好题。丙氨酸分子中的确有氢、碳、氧、氮四种原子,但正确的说法是丙氨酸是由丙氨酸分子构成,每个丙氨酸分子由四种原子构成。看图可知丙氨酸分子的化学式应该是C3H7O2N,一个丙氨酸分子中质子数是各个原子中子数之和,应该是44,丙氨酸中氮元素与氢元素的质量比为14:7就是2:1。
【答案】:C。
十三、计算质量、质量比
例13:A物质常用于焊接或切割金属。把一定质量的纯净物A和40g的纯净物B在—定条件下按下图所示充分反应,当B物质反应完时,可生成44gC物质和9gD物质。

①参加反应的A物质的质量是_____________。
②A物质中各元素的质量比为_____________。
【解析】:由模型可知:反应生成的C是二氧化碳,D是水,由生成44g二氧化碳可计算出反应前有碳元素的质量是12g,氧元素质量是32g,9g可计算出氢元素质量是1g,氧元素质量是8g。A的质量是44g+9g—40g=13g,A物质中有12g碳,1g氢。碳、氢元素质量比是12:1。
【答案】: ①参加反应的A物质的质量是13g ②A物质中碳、氢元素质量比是12:1。
十四、化学反应模型图示的规律或结论
例14:右图是氧化汞分子分解示意图。从示意图中,你能够得出的规律或者结论有:(答出两条即可)

(1)________________。(2)_________________。
【解析】:化学反应的模型就是表示了一个化学反应的进行过程,所以只要和这个反应有关的信息都可以作为它的结论,特别是化学方程式的意义,化学变化的实质是其重要的部分。如化学反应有新物质生成,化学变化分子种类要变,原子种类不变,化学反应前后原子质量数目不变,每两个氧化汞分子分解生成一个氧分子和两个汞原子等。本题是开放性题,只要合理均可。
【答案】:⑴原子是化学变化中的最小粒子。⑵在化学反应前后,原子数目没有增减。
十五、完成模型、写出反应
例15:下图是密闭体系中某反应的微观示意图,“○”和“●”分别表示不同原子。

(1)反应后方框内应再填入1个微粒(选填序号)。 A.
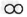 B.
B. C.
C.
(2)该反应所属的基本反应类型是__________反应。
(3)写出符合该微观示意图的一个具体反应的化学方程式______________________。
【解析】:在密闭体系中反应前后原子种类,个数均不变。反应有三个
 分子,反应后剩余一个,则反应了两个,反应前有一个
分子,反应后剩余一个,则反应了两个,反应前有一个 分子,反应后没有,则参加了反应,反应后应该生成了两个
分子,反应后没有,则参加了反应,反应后应该生成了两个 分子,所以应再填一个
分子,所以应再填一个 。反应两种物质生成一种物质,化合反应。注意没有反应的不要影响思维,当成了两种生成物。要写符合图示的反应,就要能总结出反应的特点:反应物是两种双原子分子,单质,这样的物质一般是气体,生成物是一种化合物,且个数比是1:2:2。在初中化学中比较熟悉的就是氢气燃烧。
。反应两种物质生成一种物质,化合反应。注意没有反应的不要影响思维,当成了两种生成物。要写符合图示的反应,就要能总结出反应的特点:反应物是两种双原子分子,单质,这样的物质一般是气体,生成物是一种化合物,且个数比是1:2:2。在初中化学中比较熟悉的就是氢气燃烧。【答案】:(1)C(2)化合(3)2H2+O2
 2H2O
2H2O 解题方法点拨:
要想解答好这类题目,首先,要理解和熟记微粒观点及模型图的应用,以及与之相关的知识。然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生产或生活经验所得,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。同时,还要注意以下几点:
1.运用微粒观点解释实际问题时,要先看看与哪种粒子有关,然后再联系着该粒子的有关性质进行分析解答之。
2.运用模型图来解答有关题目时,要先留意单个原子模型图的说明(即原子模型图所代表的意义和相应的元素符号),然后再逐一分析,综合考虑。尤其是,在解答用模型图来表示化学反应的题目时,一定要特别细心地进行全面思考才行;一般要做到以下“六抓”:
⑴抓分子、原子的性质,分子、原子都是构成物质的微粒;
⑵抓在化学反应中分子可分成原子,原子不能再分,但原子能重新组合成新的分子;
⑶抓分子是由原子构成的;
⑷抓化学反应前后原子的种类、数目不变;
⑸抓反应基本类型及反应物、生成物的类别;
⑹抓单个分子的构成情况;等等。
分子结构图:
由分子构成的物质:
物质是由粒子构成的,构成物质的粒子有多种,分子是其中的一种。世界上许多物质是由分子构成的,分子可以构成单质,也可以构成化合物。如:氧气、氢气、C60等单质是由分子构成的;水、二氧化碳等化合物也是由分子构成的。
分子的定义:
分子是保持物质化学性质的最小粒子。
分子的构成:


由分子构成的物质:
物质是由粒子构成的,构成物质的粒子有多种,分子是其中的一种。世界上许多物质是由分子构成的,分子可以构成单质,也可以构成化合物。如:氧气、氢气、C60等单质是由分子构成的;水、二氧化碳等化合物也是由分子构成的。
分子的定义:
分子是保持物质化学性质的最小粒子。
概念的理解:
①分子是保持物质化学性质的“最小粒子”、不是“唯一粒子”。
②“保持”的含义是指构成该物质的每一个分子与该物质的化学性质是一致的。
③分子只能保持物质的化学物质,而物质的物理性质(如:颜色、状态等)需要大量的集合体一起来共同体现,单个分子无法体现物质的物理性质。
④“最小”不是绝对意义上的最小,而是”保持物质化学性质的最小”。如果不是在“保持物质化学性质” 这层含义上,分子还可以分成更小的粒子。
用分子的观点解释问题:
物理变化和化学变化的区别
由分子构成的物质,发生物理变化时分子本身未变,分子的运动状态、分子间的间隔发生了改变;发生化学变化时分子本身发生了变化,分子分成原子,原子重新组合变成了共他物质的分子。如:水变成水蒸气,水分子本身没有变,只是分子间的问隔变大,这是物理变化;水通直流电.水分子发生了变化,生成了氢原子和氧原子,氢.原子构成氢分子,氧原子构成氧分子,这是化学变化。
分子的表示方法:
分子可用化学式表示:如O:既可表示氧气,也可表示1个氧分子。
分子的构成:

原子结构示意图:
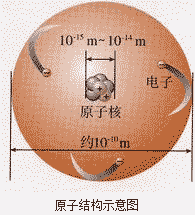
由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。

由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
| 项目 | 分子 | 原子 | |
| 不同点 | 本质区别 | 在化学反应中可以分成原子 | 在化学反应中不能再分 |
| 构成物质情况 | 大多数物质由分子构成 | 原子也能直接构成物质,但分子是由原子构成的 | |
| 相同点 | ①质量和体积都很小 ②都在不停地运动 ③粒子间有间隔 ④都是构成物质的粒子 ⑤同种粒子性质相同,不同种粒子性质不同 | ||
| 注意事项 | ①分子是保持物质化学性质的最小粒子 ②原子是化学变化中的最小粒子 ③分子是由原子构成的 ④对于由原子直接构成的物质,原子是保持其化学性质的最小粒子 | ||
| 联系 | 分子是由原子构成的,分子,原子都是构成物质的粒子,它们的关系是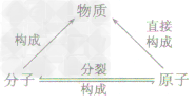 | ||
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。
单质:
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
化合物与氧化物的区别和联系:
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
| 单质 | 化合物 | ||
| 区别 | 宏观组成 | 同种元素 | 不同种元素 |
| 微观构成 | 有同种原子构成 | 由不同种原子构成 | |
| 化学性质 | 不能发生分解反应 | 一定条件下发生分解反应 | |
| 联系 | 相互转变 | 它们均属于纯净物。单质发生化合反应可以生成化合物,化合物发生分解反应可以生成单质 | |
| 质子数 | 同一种元素的原子,不论在一单质里还是在化合物里,原子核内质子数保持不变 | ||
化合物与氧化物的区别和联系:
| 化合物 | 氧化物 | |
| 区别 | ①由不同种元素组成的纯净物叫化合物 ②由两种或两种以上元素组成 ③不一定含有氧元素 ④属于纯净物中的一类 |
①由两种元素组成的化合物中,如果有一种元素是氧元素,这种化合物叫氧化物 ②一定由两种元素组成 ③一定含有氧元素 ④属于化合物中的一类 |
| 联系 | 氧化物和化合物是个体与总体的关系,氧化物属于化合物中的一类 | |
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
共价化合物与离子化合物的区别:
1. 共价化合物
(1)概念:像HCl、CO2这样以共用电子对结合在一起的化合物为共价化合物。
(2)共价化合物的类型:
①两种非金属原子结合成的化合物,如HCl、CO2等。
②非金属与酸根构成的化合物,如H2SO4、HNO3等。
2. 离子化合物与共价化合物的区别:
离子化合物是由阴、阳离子相互作用形成的化合物;共价化合物是原子间全部以共用电子对结合形成的化合物。离子化合物由离子构成,共价化合物大多数由分子构成。
发现相似题
与“如图是密闭体系中某反应的微观示意图,“”和“”分别表示不同原...”考查相似的试题有:
- 在一密闭的容器里盛有8g灼热的碳和24g氧气,充分反应后容器里的气体是( )A.CO2B.COC.CO和CO2D.CO2和O2
- 下列化学方程式正确的是[ ]A.2Ag+2HCl=2AgCl+H2B.2H2O2=2H2O+O2C.Mg+O2MgO2D.3CO+Fe2O33CO2+2Fe
- 下列化学方程式书写正确的是( )A.2H2O═2H2+O2B.Mg2+O2 点燃 . 2MgOC.CH4+2O2═CO2↑+2H2OD.4Al+3O2 点燃 . 2Al2O3
- 书写下列反应的文字表达式,并指出反应类型.(1)水通电分解____________反应(2)氢气燃烧____________反应书写反应中涉及...
- 如图是用双氧水和二氧化锰制取氧气的实验装置图,请根据此实验装置图回答下列问题:(1)A装置中使用①仪器时应当注意:______...
- 请回答实验室做铁丝在氧气中燃烧实验的有关问题:(1)集气瓶中放入少量水的目的:_________;(2)写出文字表达式:_________.
- 在氧化汞受热分解的过程中,不会发生改变的是( )A.分子的种类和个数B.物质的种类和状态C.原子的种类和个数D.分子之间的...
- 关于分子、原子的说法正确的是( )A.同种分子化学性质相同B.原子是最小的粒子C.分子大、原子小D.在化学变化中分子可分,...
- “纯净物、混合物、单质、化合物”四类物质中:①只含有一种分子的物质一定属于______;②含有两种以上分子的物质一定属于______...
- 现有①水蒸气;②铁粉;③高锰酸钾;④医用75%的酒精;⑤湖水;⑥氧化铁六种物质,其中属于混合物的有(填序号,下同)______,属于...