本试题 “今年春季,西南地区持续干旱.在云南会泽,当地村民把河床里仅剩的泥沙水也舀起当作饮用水.当地政府部门为了灾民的身体健康,需要对河水进行净化处理.(1)...” 主要考查您对硬水和软水
水的净化
化学反应方程式的书写
文字表达式
构成物质的微粒(分子、原子、离子)
物质的相互转化和制备
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 硬水和软水
- 水的净化
- 化学反应方程式的书写
- 文字表达式
- 构成物质的微粒(分子、原子、离子)
- 物质的相互转化和制备
定义:
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
定义:
清除水中不好的或不需要的杂质,使水达到纯净的程度。
四种净化水的方法,原理,作用:
| 净化水的方法 | 原理 | 作用 |
| 沉淀 | 食难溶性的杂质沉淀下来,并与水分层 | 使难溶性大颗粒沉降或加入明矾,形成的胶状物吸附杂质沉降 |
| 过滤 | 把液体与难溶于液体的固体物质分离 | 除去难溶性杂质 |
| 吸附 | 利用物质的吸附作用,吸附水中一些难溶性杂质,臭味和色素 | 除去难溶性杂质,部分可溶性杂质,臭味和色素 |
| 蒸馏 | 通过加热的方法使水变成水蒸气后冷凝成水 | 除去可溶性杂质,使硬水软化 |
水净化的方法:
吸附,沉淀,过滤,蒸馏,杀菌
吸附:常用明矾和活性炭,明矾溶于水后形成胶状物吸附水中的悬浮物,
活性炭不仅可以吸附水中的悬浮物,还可以吸附在水中有异味的物质和色素
沉淀:水中悬浮物别吸附后形成密度大的颗粒,从而使杂质沉淀
过滤:除去水中不溶性的杂质
蒸馏:除去可溶性杂质的方法
杀菌:常用杀毒剂:漂白粉,氯气以及新型消毒剂二氧化氯等
吸附、沉淀、过滤和蒸馏中单一操作净化程度较高的是蒸馏。综合运用时,按吸附→沉淀→过滤→蒸馏的顺序操作净化效果更好
加絮凝剂(明矾)与活性炭净水的比较:
| 净化水的方法 | 原理 | 能除去的杂质 |
| 明矾净水 | 明研溶于水后形成胶状物质,对杂质进行吸附,将微小颗粒吸附在一起形成大的固体颗粒而沉阵下来 | 不溶于水的微小固体颗粒 |
| 活性炭净水 | 利用内部疏松多孔的结构来吸附水中的微小颗粒和一些可溶于水的杂质 | 不溶于水的微小固体颗粒和部分能溶于水的杂质以及气味,颜色等 |
自来水厂净化水的过程图及步骤
1、净化过程图
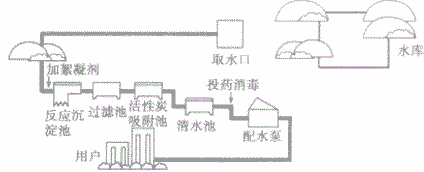
2、自来水净化步骤
①从水库中取水。
②加絮凝剂(主要是明矾),使悬浮的小颗粒状杂质被吸附凝聚。
③在反应沉淀池中沉降分离,使水澄清
④将沉淀池中流出的较澄清的水通入过滤池中,进一步除去不溶性杂质。
⑤再将水引人活性炭吸附池中,除去水中的臭味和残留的颗粒较小的不溶性杂质。
⑥细菌消毒(常用通入氯气的办法)。它是一个化学变化过程,因为除去病菌的过程.就是把病菌变成其他物质的过程。
⑦杀菌后的水就是洁净、可以饮用的自来水,通过配水泵供给用户,但水中仍然含有可以溶于水的一些杂质,所以还是混合物。
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
概念:用文字表示化学反应的式子
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
构成物质的微粒:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
分子和原子的比较:
原子与离子的比较:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
| 分子 | 原子 | 离子 | |
| 概念 | 保持物质化学性质的最小粒子 | 是化学变化中的最小粒子 | 带电的原子或原子团 |
| 表示方法 | 用化学式表示. 如H2,He | 用元素符号表示,如H,Fe | 用离子符号表示,如Na+、NO3- |
| 微粒的运动 | 物理变化是分子运动的结果,如:水的蒸发 | 化学变化是原子运动的结果. 如:水的电解 | 离子运动的结果可能是物理变化。也可能是化学变化,如:NaCl的溶解是物理变化, NaCl与AgNO3反应是化学变化 |
| 化学计量数与符号的关系 | 化学式、元素符号、离子符号前加上化学计量数,如2H,2H2,3Na+,只表示原子、分子、离了的“个数”,不表示元素和物质 | ||
| 联系 |  | ||
分子和原子的比较:
| 原子 | 分子 | |
| 定义 | 化学变化中的最小粒子 | 保持物质(由分子直接构成的物质)化学性质的最小粒子 |
| 相同点 | ①都是构成物质的基本粒子,有些物质是由分子构成的.有些物质是由原子直接构成的; ②都很小,但者阶一定的体积和质量; ③都在不断地运动; ④微粒子间都有间隔; ⑤都能保持物质的化学性质 | |
| 区别 | 化学变化中不能再分 | 化学变化中可以再分 |
| 如:在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子 | ||
| 同种原子具有相同的质子数 | 同种分子化学性质相同 | |
| 联系 | 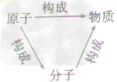 | |
原子与离子的比较:
| 原子 | 离子 | |
| 概念 | 化学变化中最小粒子 | 带电荷的原子或原子团 |
| 电性 | 呈电中性,不带电 | 带电: 阳离子带正电 阴离子带负电 |
| 表示方法 | 用元素符号表示;Na 表示钠原子,2Na表示2个钠原子 | 在元素符号右上角先写电荷数,后标出电性 (+、-):Na+表示钠离子,2Na+表示2个钠离子 |
| 数量关系 | 核内质子数=核外电子数 | 阳离子:核内质子数> 核外电子数 阴离子:核内质子数< 核外电子数 |
| 相似点 | 都是构成物质的一种粒子 | |
| 转化 |  | |
物质的相互转化和制备:
主要是指以氧气、氢气、碳、硫、磷等为代表的非金属单质,以铝、镁、锌、铁、铜为代表的金属单质,以一氧化碳、二氧化碳等为代表的非金属氧化物,以氧化铜、氧化铁等为代表的金属氧化物,以盐酸、硫酸、碳酸等为代表的酸,以氢氧化钠、氢氧化钙等为代表的碱,以氯化钠、碳酸钠、碳酸氢钠、碳酸钙等为代表的盐,等等物质之间的相互和制备.
物质的相互转化:
氢氧化钠与氢氧化钙的制备:
(1)NaOH的制备
方法一:Na2O+H2O==2NaOH
方法二:Na2CO3+Ca(OH)2==CaCO3↓ +2NaOH
(2)Ca(OH)2的制备方法:CaO+H2O==Ca(OH)2
常见物质的相互转化:
Na→Na2O→NaOH→Na2CO3
C→CO→CO2→H2CO3
Fe→Fe2O3→Fe2(SO4)3→Fe(OH)3→FeCl3
S→SO2→SO3→H2SO4(单质硫不能直接转化为SO3)
各类物质间的转化关系:
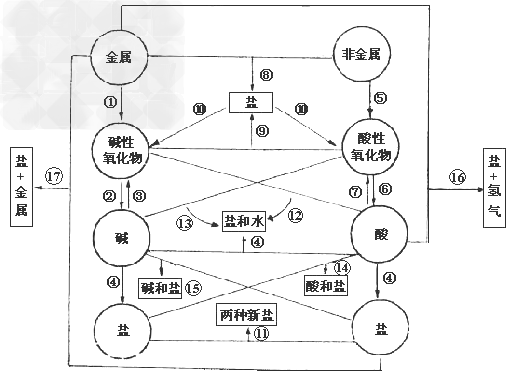
(1)金属+
 金属氧化物(碱性氧化物)
金属氧化物(碱性氧化物) 
(2)碱性氧化物(可溶)+水
 碱(可溶)
碱(可溶)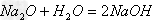
(3)碱(难溶)
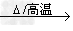 碱氧(难溶)+水
碱氧(难溶)+水 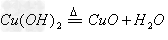
(4)酸+碱
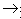 盐+水
盐+水  ;
;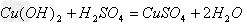
(5)非金属+
 非金属氧化物(酸性氧化物)
非金属氧化物(酸性氧化物)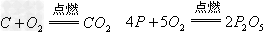
(6)酸性氧化物(易溶)+水
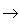 酸(易溶)
酸(易溶)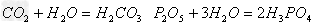
(7)酸(易挥发/难溶)
 酸氧+水(易挥发/难溶)
酸氧+水(易挥发/难溶) 
从纵向来看,金属
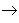 碱性氧化物
碱性氧化物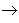 碱
碱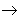 盐,其中金属元素相同。
盐,其中金属元素相同。非金属
 酸性氧化物
酸性氧化物 酸(含氧酸)
酸(含氧酸) 盐,其中非金属元素相同。
盐,其中非金属元素相同。横向:
(8)金属+非金属(无氧酸)
 盐
盐 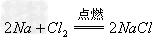
(9)碱氧+酸氧(含氧酸)
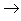 盐
盐
(10)含氧酸盐
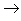 碱氧+酸氧
碱氧+酸氧
(11)盐+盐
 两种新盐
两种新盐 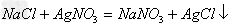
交叉:
(12)酸+碱氧
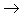 盐+水
盐+水
(13)碱+酸氧
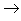 盐+水
盐+水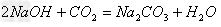
(14)酸+盐
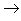 新酸+新盐
新酸+新盐 ;
;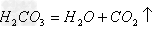
(15)碱+盐
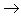 新碱+新盐
新碱+新盐
(16)金属+酸
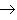 盐+
盐+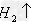
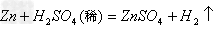
(17)金属+盐
 新盐+新金属
新盐+新金属(18)金属+盐
 新盐+新金属
新盐+新金属 (置换反应)
(置换反应) 发现相似题
与“今年春季,西南地区持续干旱.在云南会泽,当地村民把河床里...”考查相似的试题有:
- (1)硬水会给生产、生活带来许多不便.区别硬水和软水时,你的简单做法是______.日常生活中可以通过煮沸来降低水的硬度.硬...
- 下列说法正确的是( )A.河水、井水、海水是混合物,自来水是纯净物B.液态的水分子不断运动,固态的水分子不运动C.水由气...
- 生活中的“柴、米、油、盐”中蕴含了许多化学知识,请用回答:(1)有人利用潲水油、地沟油烹调食品损害人民健康,而有人则利用...
- 将一洁净的铁钉放入硫酸铜溶液中,过一会儿在铁钉表面看到的现象是 ,该反应的化学方程式为 。
- 下列化学方程式正确的是( )A.CuO+H2═Cu+H2OB.Zn+H2SO4═ZnSO4+H2↑C.3CO+Fe2O3 高温 . 2Fe+3CO2↑D.2CuO+C 高温 . 2Cu+CO2
- 百花盛开,阵阵花香,沁人心脾.花香四溢的现象说明( )A.分子是不断运动的B.分子是由原子构成的C.分子具有一定的质量D....
- 2011年3月,日本海啸引发福岛第一核电站的放射性物质外泄,有关131I(碘-131)的相关报道成为热门话题.请回答下列问题:(1...
- 物质是由 ____、_____、 _____等微粒构成的,例如氧气是由 _________构成的,铁是由 __________构成的,氯化钠是由 _________...
- 工业制玻璃的原料是______、______、______.在玻璃窑中发生反应的化学方程式是______,______.
- (09贺州)下列叙述错误的是( )A.用燃烧的方法区别羊毛和涤沦B.用肥皂水区别硬水和软水C.用观察外观的方法区别黄金和假...