本试题 “小宇同学做细铁丝在氧气中的燃烧实验时,他把细铁丝绕成螺旋状,一端系在一根铁丝上,另一端系上一根火柴.点燃火柴后迅速把铁丝连同火柴一起插入集气瓶下部...” 主要考查您对化学实验操作的注意事项
氧气的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学实验操作的注意事项
- 氧气的性质
化学实验操作应遵循的七个原则:
1.“从下往上”原则。
2.“从左到右”原则。装配复杂装置应遵循从左到右顺序。
如上装置装配顺序为:发生装置→集气瓶→烧杯。
3.先“塞”后“定”原则。
4.“固体先放”原则。
5.“液体后加”原则。
6.先验气密性(装入药口前进行)原则。
7.后点酒精灯(所有装置装完后再点酒精灯)原则。
化学实验中的“七个关系”
(1)先后关系
①向试管中装人固体粉末时,先将试管倾斜,把盛药品的药匙送至试管底部,然后让试管直立,使药品全部落到试管底;向试管中放入块状固体时,先把试管横放,用镊子把药品放在试管口,然后将试管慢慢竖立起来使固体缓慢落到试管底。
②用胶头滴管吸取少量液体时,先在滴瓶外面挤压胶头排出滴管内的空气,然后再伸入滴瓶内松手吸取液体。
③用托盘天平称量药品时,先游码归零,再调节平衡,然后称量。
④给玻璃仪器加热时,先把仪器外壁擦干,然后再加热。
⑤给试管中的药品加热时,先使试管均匀受热,然后对盛放药品的部位固定加热。
(2)左右关系
①用托盘天平称量药品时,药品放在左盘,砝码放在右盘。
②连接实验装置时,应按从左到右(或自下而上)的顺序进行,拆除时顺序相反。
③橡胶塞和橡胶管与玻璃管连接时,左手拿橡胶塞或橡胶管,右手拿玻璃管(玻璃管一端用水润湿);给容器塞橡胶塞时,左手拿容器,右手拿塞子。
(3)上下关系
①给试管中的固体加热时,试管口应略向下倾斜;给试管中的液体加热时,试管口应向上倾斜(与桌面大约成45。角)。
②用试管夹夹持试管时,应从试管底部向上套,夹在试管的中上部。
③手拿试剂瓶倾斜液体试剂时,应让标签向上对着手心。
(4)正倒关系
①取试剂瓶里的药品时,拿下瓶塞,倒放在桌上。
②用胶头滴管取完液体时,胶头滴管应该正放 (保持胶头向上),而不能倒放或平放。
(5)多少关系
①实验时,如果没有说明药品用量,应取最少量,即液体取1~2mL,固体只需盖满试管底部。
②酒精灯内酒精的量不得超过酒精灯答积明了2/3。
③加热时,试管内液体的体积不能超过其容积的1/3,蒸发皿内液体的体积不能超过其容积的2/3。
(6)内外关系
①用洒精灯加热时.应该用外焰加热。
②使用胶头滴管向试管中滴加液体时,滴管应悬空在试管口的止上方,不能伸入试管内。
(7)高低关系
过滤时,滤纸的边缘要低于漏斗边缘,液面要低于滤。纸边缘
实验仪器使用的注意事项:
| 名称 | 图示 | 使用时的注意事项 |
| 试管 |  |
(1)可直接加热 (2)拿取试管时,用中指、食指、拇指夹住距试管口1/3 处:振荡时,用右手拇指、食指和中指夹持试骨的上端,使用腕力甩动试管底部。 (3)加热时要使用试管夹 (4)加热液体时,液体体积不超过试管容积的1/3·使试管与桌面成45。角。试管口不要对着自己或他人 (5)加热固体时试管口略向下倾斜 (6)加热前试管外壁擦干,加热时受热要均匀,不受碰到酒精灯的灯芯 (7)加热后不能骤冷,防止炸裂 |
| 蒸发皿 |  |
(1)用坩埚钳夹持,放在三脚架或铁架台的铁圈上直接加热 (2)加热后不能骤冷,防止破裂 (3)加热后不能直接放到实验桌上以免烫坏实验桌 (4)液体量多时可直接加热.量少或黏稠液体要垫石棉网加热 |
| 燃烧匙 |  |
(1)可以直接加热 (2)不可连续高温使用,以免端头脱焊掉落 (3)用后洗净擦拭干净.防止反应物与燃烧匙反应或生锈 |
| 烧杯 |  |
(1)加热时应放在石棉网上,使其受热士均匀,以防受热不均而炸裂 (2)溶解固体时要用玻璃棒轻轻搅拌.搅拌时玻璃捧不能接触器壁,防止碰破烧杯 |
| 锥形瓶,烧瓶(圆底,平底) |  |
加热时需垫上石棉网,以防受热不均而炸裂 |
| 酒精灯 |  |
(1)酒精量不得超过酒精灯容积的2/3,不得少于1/4。量多受热易溢出,量少则酒精蒸气易引火爆炸 (2)禁止向燃着的酒精灯里添加酒精;点燃酒精灯用火柴,禁止用燃着的酒精灯去引燃另一盏酒精灯,防止酒精溢出发生火灾 (3)应用外焰加热,外焰酒精充分燃烧,温度高 (4)熄灭时不能用嘴吹灭,应用灯帽盖灭而且要反复盖两次,目的是防止火焰进入灯内引燃酒精失火,同时防止下次用时打不开 |
| 集气瓶 |  |
(1)不允许加热,防止受热破裂 (2)用于物质和气体的某些放热反应时,集气瓶内要放人少量水或细沙,以防止受热炸裂 (3)集气瓶和广口瓶外形相似,但磨口的部位不同,集气瓶磨砂在瓶口上表面,广口瓶磨砂在瓶口内侧 |
| 滴管,滴瓶 |  |
(1)瓶塞不能弄脏、弄乱,防止沾污试剂: (2)盛放碱液改用胶塞: (3)有色瓶盛见光易分解或不太稳定的试剂: (4)滴瓶上的滴管专用,不可冲洗; |
| 细口瓶 |  | |
| 广口瓶 |  | |
| 托牌天平 | 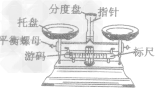 |
(1)使用前先调零: (2)不能在托盘上直接放置药品,用称量纸或小烧杯称量; (3)左物右码,添加砝码顺序应从大到小: (4)用镊子取用砝码、拨游码 |
| 量筒 |  |
(1)不可加热,不可作反应容器: (2)根据液体的量选择规格; (3)读数时,视线应与凹液面最低处保持水平 |
| 普通漏斗 |  |
(1)过滤时,要使滤纸边缘低于漏斗边缘,漏斗内的液面要低于滤纸边缘,用水湿润滤纸并使之紧贴漏斗内壁.中间不能留有气泡 (2)过滤时要用玻璃棒引流 |
| 长颈漏斗 |  |
长颈漏斗的下端管口要插入液面以下,形成液封,避免产生的气体从长颈漏斗中逸出 |
| 分液漏斗 |  |
分液漏斗的下端不必插入液面以下 |
| 铁架台 |  |
(1)铁圈、铁夹方向应与铁架台底盘同侧; (2)铁夹夹在试管中上部; (3)夹持玻璃仪器时,勿过松或过紧,应以恰好使玻璃仪器不能移动,以防仪器脱落或夹碎 |
| 试管夹 |  |
(1)夹在试管中上部; (2)从试管底部套入、取出; (3)拇指不要按在试管夹的短柄上 |
| 坩埚钳 |  |
(1)尖端向上平放在实验台上; (2)温度高时应放往石棉网网上 |
| 水槽 |  |
(1)水不要加满,防止实验时有水溢出 (2)防止打碎,不能加热 |
| 药匙 |  |
(1)每次用完及时用纸擦干净 (2)保持洁净、干燥 |
| 玻璃棒 |  |
(1)搅拌时切勿撞击器壁,以免碰破容器; (2)注意随时洗涤、擦净; (3)过滤或转移液体时,使液体沿玻璃棒流下,防止液体洒出或溅出 |
| 石棉网 |  |
不能与水接触,防止石棉脱落或铁丝生锈 |
| 试管刷 |  |
刷洗试管时,不要用力过猛,以免损坏容器 |
| 温度计 |  |
(1)温度计不允许测量超过它的最高量程的温度 (2)温度计不能当搅拌器使用,以防水银球破裂 (3)刚刚测量过高温的温度计不可以立即用冷水冲洗,以防骤冷破裂 |
化学实验基本操作口诀:
固粉需匙或纸槽,一横二送三直立。
块固还是镊子好,一横二放三慢竖。
液体应盛细口瓶,手贴标签再倾倒。
量筒读数切面平,仰视偏低俯视高。
滴管滴加捏胶头,垂直悬空不沾污。
不平不倒不乱放,用完清洗莫忘记。
托盘天平须放平,游码旋螺针对中。
左放物来右放码,镊子夹大后夹小。
试纸测液先剪小,玻棒蘸液测最好。
试纸测气先湿润,粘在棒上向气靠。
酒灯加热用外焰,三分之二为界限。
硫酸入水搅不停,慢慢注入防沸溅。
实验先查气密性,隔网加热杯和瓶。
排水集气完毕后,先撤导管后移灯。
化学实验意外事故的处理:
| 意外事故 | 处理方法 |
| 使用酒精灯时烫伤 | 立即用水冲洗烫伤处,再涂上烫伤膏 |
| 使用玻璃管时划伤手指 | 立即进行消毒再包扎处理 |
| 眼睛里溅进了酸或碱溶液 | 立即用水冲洗,切不可用手揉眼睛,洗的时候要眨眼睛,必要时请医生治疗 |
| 洒在桌面上的酒精燃烧起来 | 立即用湿抹布或沙子扑灭 |
| 浓硫酸飞溅到皮肤上 | 立即用大量水冲洗再涂上3%~5%的小苏打溶液 |
| 误服氯化钡溶液 | 立即喝大量鲜牛奶或鸡蛋清 |
| NaOH溶液溅到皮肤上 | 立即用大量水冲洗再涂上硼酸溶 |
实验安全操作的注意事项:
(1)防倒流倒:吸用试管加热固体时,试管底部要略高于管口,如用KClO3和MnO2、KMnO4制取氧气加热法制取并用排水法收集气体时容易发生倒吸,要注意熄灯顺序。
(2)防爆炸:点燃可燃性气体或用CO、H2还原Fe2O3、CuO之前,要检验气体纯度。
(3)防暴沸:加热液体或蒸馏时常在加热的装置中加入沸石或碎瓷片,防止液体暴沸。
(4)防失火:实验室中的可燃物质一定要远离火源。
(5)防腐蚀:强酸、强碱对皮肤有强烈的腐蚀作用,如果皮肤上沾有强酸、强碱要用水冲洗,再涂抹3%一5%NaHCO3 溶液、硼酸,
(6)防中毒:在制取或使用有毒气体时,应在通风橱中进行,注意尾气处理。如用CO还原Fe2O3、CuO要处理好尾气.
(7)防炸裂:普通玻璃制品都有受热不均匀易炸裂的特性,因此:
①试管加热时先要预热;
②做固体在气体中燃烧实验时要在集气瓶底预留少量水或铺一层细沙;
③注意防止倒吸。
(8)防堵塞:加热高锰酸钾制氧气时,在试管口放一团棉花。
(9)防污染:
①已取出的未用完的试剂一般不放回原瓶(块状固体。如钠、白磷除外);
②用胶头滴管滴加液体时,不伸入瓶内,不接触试管壁;
③取用试剂时试剂瓶盖倒放子桌面上;
④药匙和胶头滴管尽可能专用(或洗净、擦干后再取其他药品);
⑤废液及时处理。
(10)防意外:
(1)中毒事故防止和处理一氧化碳中毒时应迅速离开所处房间,到通风良好的地方呼吸新鲜空气。误食重金属盐(如铜盐、铅盐、银盐等)应立即服用生蛋白或生牛奶。
(2)火灾处理
①酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖;
②钠、磷等失火宜用沙土扑盖;
③会用干粉及泡沫火火器;
④拔打火警电话“119”、急救电话 “120”,也可拨“110”求助;
⑤因电失火应先切断电源,再实施灭火。
定义:
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体) 液氮(淡蓝色液体)
液氮(淡蓝色液体)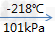 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)
(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2 2MgO
2MgO
3Fe+2O2 Fe3O4
Fe3O4
②与非金属的反应:
C+O2 CO2(O2充分)
CO2(O2充分)
2C+O2 2CO(O2不充分)
2CO(O2不充分)
③与化合物的反应:
2CO+O2 2CO2
2CO2
CH4+2O2 CO2+2H2O
CO2+2H2O
C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体)
 液氮(淡蓝色液体)
液氮(淡蓝色液体) 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2
 2MgO
2MgO3Fe+2O2
 Fe3O4
Fe3O4②与非金属的反应:
C+O2
 CO2(O2充分)
CO2(O2充分)2C+O2
 2CO(O2不充分)
2CO(O2不充分)③与化合物的反应:
2CO+O2
 2CO2
2CO2CH4+2O2
 CO2+2H2O
CO2+2H2OC2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
发现相似题
与“小宇同学做细铁丝在氧气中的燃烧实验时,他把细铁丝绕成螺旋...”考查相似的试题有:
- 在下列实验操作(或措施)与理由的关系中,不正确的是[ ]A.用过氧化氢制氧气时,向过氧化氢溶液中加入少量MnO2--加快分解速...
- 下列对实验现象或实验操作的叙述正确的是( )①铁丝在空气中燃烧产生黄色火焰;②镁条在空气中燃烧发出耀眼的白光;③将CO还原F...
- 下列所示实验操作中,正确的是[ ]A.B.C.D.
- 下列对实验意外事故的处理错误的是( )A.若不慎将燃着的酒精灯碰倒,洒出的酒精在桌上燃烧,应立刻用湿抹布扑盖B.若不慎将...
- 下列实验基本操作正确的是[ ]A.点燃酒精灯B.倾倒液体C.检查气密性D.给液体加热
- 以下各图所表示的实验操作中错误的是[ ]A.B.C.D.
- 如图所示是四项实验操作:(1)指出其中有关仪器名称:①______,②______,③______,④______.(2)其中正确的操作是______.
- 小科利用如图所示装置,做NaHCO3受热分解的实验。(1)加热一段时间后,观察到烧杯中的澄清石灰水变__________。(2)实验结束时...
- 下图是几种元素的原子结构示意图,请根据题目要求填写下列空白.(1)属于金属元素的是______(填序号),其原子结构特点为__...
- 氧气是空气的主要成分之一,有关氧气说法错误的是[ ]A.用带火星的木条可以检验氧气B.用加热高锰酸钾的方法可以制取氧气C....