本试题 “对可逆反应4NH3(g)+ 5O2(g)4NO(g)+ 6H2O(g),下列叙述正确的是A.达到化学平衡时,5υ正(O2)= 4υ逆(NO)B.若单位时间内生成x mol NO的同时,消耗x...” 主要考查您对化学反应进行的方向
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应进行的方向
化学反应的方向与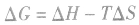 :
:
1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如 ,稳定性
,稳定性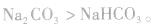
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如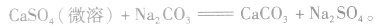
②由相对强酸(碱)向相对弱酸(碱)转变,如 ,
,  所以酸性强弱:
所以酸性强弱: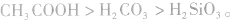
(3)由难挥发性物质向易挥发性物质转变
如 所以沸点:
所以沸点: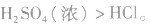
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如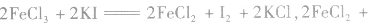
 ,则氧化性:
,则氧化性: 。
。
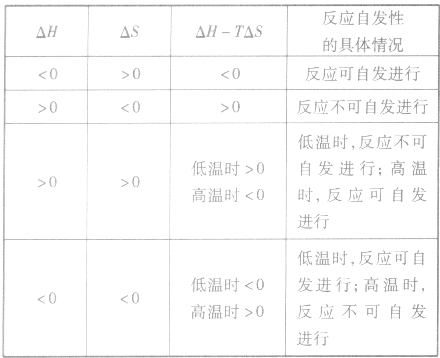
2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向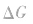
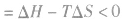 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;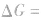
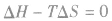 表明反应已达到平衡状态;
表明反应已达到平衡状态;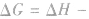
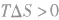 表明反应不能自发进行。
表明反应不能自发进行。
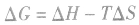 :
:1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如
 ,稳定性
,稳定性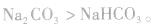
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如
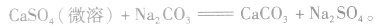
②由相对强酸(碱)向相对弱酸(碱)转变,如
 ,
,  所以酸性强弱:
所以酸性强弱: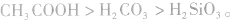
(3)由难挥发性物质向易挥发性物质转变
如
 所以沸点:
所以沸点: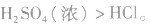
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如
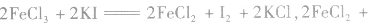
 ,则氧化性:
,则氧化性: 。
。 2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向
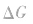
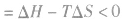 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;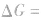
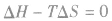 表明反应已达到平衡状态;
表明反应已达到平衡状态;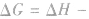
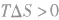 表明反应不能自发进行。
表明反应不能自发进行。
发现相似题
与“对可逆反应4NH3(g)+ 5O2(g)4NO(g)+ 6H2O(g),下列叙...”考查相似的试题有:
- 我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是[ ]A.反应进行的方向B.反应的快慢C.反应进行的限度D...
- 可逆反应aA(g)+bB(g)cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的规律是( )A.a+b>c+d T1>T2 ΔH>0B.a+b>c+d T1
- 在密闭容器中,反应:CH4(g)+H2O(g)CO(g)+3H2(g)△H>0,达到平衡状态。下列叙述正确的是 ( )A.增加甲烷的量,上...
- 一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是① 混合...
- 难挥发性二硫化担(TAS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中....
- 下列推论正确的是[ ]A.S(g)+O2(g)=SO2(g) △H1,S(s)+O2(g)=SO2(g) △H2;则:△H1>△H2B.C(石墨,s)=C(金刚石,s) △H=+1.9kJ/...
- 在给定条件下,下列加点的物质在化学反应中能被完全消耗的是( )A.用10mLl0mol•L-1浓盐酸与10g二氧化锰(式量为87)共热制...
- 可逆反应2NO22NO+O2在恒容密闭容器中反应,能说明反应已达到平衡状态的是 ①单位时间内生成n mo1 O2的同时生成2n mol NO2②单位...
- 下列说法正确的是[ ]A.放热反应一定是自发进行的反应B.吸热反应一定是非自发进行的C.自发进行的反应一定容易发生D.有些吸...
- 下列判断正确的是[ ]A.常温下,反应不能自发进行,则该反应的B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的...