本试题 “下列说法中不正确的是( )A.制普通玻璃的原料主要是纯碱、石灰石和石英B.将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性C.硅...” 主要考查您对胶体
单质硅
二氧化硅
二氧化硫
玻璃、陶瓷、水泥
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 胶体
- 单质硅
- 二氧化硅
- 二氧化硫
- 玻璃、陶瓷、水泥
胶体:分散质粒子直径在10-9m~10-7m之间的分散系胶粒直径的大小是胶体的本质特征
胶体可分为固溶胶、液溶胶、气溶胶
①常见的液溶胶:Fe(OH)3、AgI、牛奶、豆浆、粥等
②常见的气溶胶:雾、云、烟等;
③常见的固溶胶:有色玻璃、烟水晶等胶体的性质:
丁达尔效应:
①当光束通过氢氧化铁胶体时,可以看到一条光亮的通路,这条光亮的通路是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,即为丁达尔效应。
②布朗运动:粒子在不停地、无秩序的运动
③电泳:胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里定向移动。一般来讲:金属氢氧化物,金属氧化物的胶粒吸附阳离子,胶体微粒带正电荷;非金属氧化物,金属硫化物的胶体胶粒吸附阴离子,胶体微粒带负电荷。
④胶体聚沉:向胶体中加入少量电解质溶液时,由于加入的阳离子(或阴离子)中和了胶体粒子所带的电荷,使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出。该过程不可逆。
胶体的特性:
(1)丁达尔效应当一束光通过胶体时,胶体内会出现一条光亮的通路,这是由胶体粒子对光线散射而形成的,利用丁达尔效应可区分胶体和浊液。
(2)介稳性:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,但改变条件就有可能发生聚沉。
(3)聚沉:给胶体加热、加入电解质或加入带相反电荷的胶体颗粒等均能使胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析出。聚沉常用来解释生活常识,如长江三角洲的形成、明矾净水等。
(4)电泳现象:在电场作用下,胶体粒子在分散剂中作定向移动。电泳现象说明胶体粒子带电。电泳常用来分离提纯胶体,如工业上静电除尘。
分散系比较:
| 分散系 | 溶液 | 胶体 | 悬浊液 | 乳浊液 |
| 分散质粒子大小 | <1nm | 1~100nm | >100nm | >100nm |
| 分散质粒子结构 | 分子、离子 | 少量分子的结合体或大分子 | 大量分子聚集成的固体小颗粒 | 大量分子聚集成的液体小液滴 |
| 特点 | 均一、透明、稳定 | 多数均一、透明、较稳定 | 不均一、不透明、久置沉淀 | 不均一、不透明、久置分层 |
| 能否透过滤纸 | 能 | 能 | 不能 | —— |
| 实例 | 食盐水、蔗糖溶液 | Fe(OH)3(胶体)、淀粉胶体 | 泥水、石灰乳 | 牛奶、油漆 |
胶体发生聚沉的条件:
因胶粒带电,故在一定条件下可以发生聚沉:
- 向胶体中滴加电解质
- 向胶体中加入带相反电荷胶粒的胶体
- 加热
常见的胶体的带电情况:
- 胶粒带正电荷的胶体有:金属氧化物、金属氢氧化物。例如Fe(OH)3、Al(OH)3等。
- 胶粒带负电荷的胶体有:非金属氧化物、金属硫化物、硅酸胶体、土壤胶体。
- 胶粒不带电的胶体有:淀粉胶体。
- 特殊的,AgI胶粒随着AgNO3和KI相对量不同,而带正电或负电。若KI过量,则AgI胶粒吸附较多I-而带负电;若AgNO3过量,则因吸附较多Ag+而带正电。
注意:胶体不带电,而胶粒可以带电。
Fe(OH)3胶体的制备:
操作步骤:将烧杯中的蒸馏水加热至沸腾,向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至呈红褐色为止。
离子方程式:Fe3++3H2O=(加热)=Fe(OH)3(胶体)+3H+
点拨:(1)淀粉溶液、蛋白质溶液虽叫做溶液,但属于胶体。
(2)胶体可以是液体,也可以是固体、气体,如烟、云、雾、有色玻璃等。
硅:
①元素符号:Si
②原子结构示意图: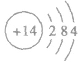
③电子式: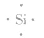
④周期表中位置:第三周期ⅣA族
⑤含量与存在:在地壳中的含量为26.3%,仅次于氧,在自然界中只以化合态存在
⑥同素异形体:晶体硅和无定形硅
硅的物理性质和化学性质:
(1)物理性质:晶体硅是灰黑色,有金属光泽,硬而脆的固体,它的结构类似金刚石,具有较高的沸点和熔点,硬度也很大,它的导电性介于导体和绝缘体之间,是良好的半导体材料。 (2)化学性质:化学性质不活泼
①常温下,除与氟气、氢氟酸及强碱溶液反应外,与其他物质不反应 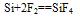
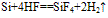 (雕刻玻璃)
(雕刻玻璃)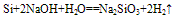
②在加热条件下,能与氧气、氯气等少数非金属单质化合
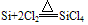
(4)制备:在电炉里用碳还原二氧化硅先制得粗硅: ,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为:
,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为: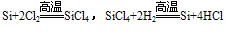 。
。
碳族元素中碳和硅的一些特殊规律:
1.金刚石和晶体硅都是原子晶体,但金刚石不导电,晶体硅能导电.且金刚石的熔点(大于3550℃)比硅的熔点(1410℃)高;石墨是过渡型晶体或混合型晶体,也能导电。
2.碳和硅都能跟O2反应生成氧化物,碳的两种氧化物CO和CO2在常温下是气体,而硅的氧化物SiO2 在常温下是固体。
3.碳跟碱溶液不反应,而硅跟碱溶液能反应。
Si+2NaOH+H2O==Na2SiO3+2H2↑
4.碳在高温时能跟水蒸气反应,而硅不能。
C+H2O(g) CO+H2
CO+H2
5.碳跟氢氟酸不反应,而硅能跟氢氟酸反应。
Si+4HF==SiF4↑+2H2↑
6.碳能被浓硫酸(或浓硝酸)氧化生成二氧化碳,但硅不能被浓硫酸(或浓硝酸)氧化。
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
C+4HNO3(浓) 4NO2↑+2H2O+CO2↑
4NO2↑+2H2O+CO2↑
7.碳和硅都具有还原性,且硅的还原性比碳强,但在高温时碳能把硅从SiO2中还原出来。
2C+SiO2 Si+2CO↑
Si+2CO↑
8.碳的氯化物都不能自燃,而SiH4能自燃。
SiH4+2O2==SiO2+2H2O
9.通常情况下,周态CO、CO2都是分子晶体,熔、沸点都很低;而SiO2是原子晶体,熔、沸点较高。
10.CO2溶于水且能跟水反应生成碳酸,SiO2却不能.
11.CO2跟氢氟酸不反应,而SiO2能跟氢氟酸反应.
SiO2+4HF==SiF4↑+2H2O
12.CO2跟碱溶液反嘘生成正盐或酸式盐,而SiO2 跟碱溶液反应只生成正盐。
CO2+2NaOH==Na2CO3+H2O
CO2+NaOH==NaHCO3
SiO2+2NaOH==Na2SiO3+H2O
13.在溶液中Na2SiO3可转变为Na2CO3,而在高温条件下Na2CO3又可转变为Na2SiO3。
Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
硅及其化合物的几种反常现象:
1.Si的还原性大于C,但C却能在高温下还原出Si 可从平衡移动的角度理解,由于高温下生成了气态物质CO2它的放出降低了生成物的浓度,有利于应反正向进行,故可发生反应:SiO2+2C Si+2CO↑
Si+2CO↑
2.部分非金属单质能与碱溶液反应,但其中只有 Si与碱反应放出H2 常见的非金属单质与碱溶液的反应有:
Cl2+2NaOH==NaCl+NaClO+H2O①
3S+6NaOH 2Na2S+Na2SO3+3H2O②
2Na2S+Na2SO3+3H2O②
Si+2NaOH+H2O==Na2SiO3+2H2↑③
在反应①②中,Cl2、S既作氧化剂又作还原剂:在反应③中,Si为还原剂。
3.非金属单质一般不与弱氧化性酸反应,而硅不但能与氢氟酸反应,而且还会产生H2
4.硅酸不能由相应的酸酐与水反应制得制取硅酸的实际过程很复杂,条件不同可得到不同的产物,通常包括原硅酸(H2SiO4)及其脱水得到的一系列酸。原硅酸经两步脱水变为SiO2,SiO2是硅酸的酸酐,是一种不溶于水的同体,不能直接用它制备硅酸,用SiO2制取硅酸时,可先将SiO2溶于烧碱中,再向溶液中加入足量的盐酸或通入过量的CO2,析出的胶状物就是原硅酸,将原硅酸在空气中脱水即得硅酸,反应原理可理解为:
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+CO2+2H2O==Na2CO3+H4SiO4↓
H4SiO4==H2SiO3+H2O
5.非金属氧化物的熔沸点一般较低,但SiO2的熔沸点却很高非金属氧化物一般为分子晶体,但SiO2为原子晶体。分子晶体中分子以分子问作用力相结合,而分子间作用力很弱,破坏它使晶体变为液体或气体比较容易;而在SiO2晶体中每个硅原子与四个氧原子相结合,形成硅氧四面体,在每个硅氧四面体结构单元中Si—O 键的键能很高,同时硅氧四面体结构单元可通过共用顶角氧原子连成立体网状结构,所以要使它熔融,必须消耗更多的能量,因此SiO2的熔沸点很高。
6.SiO2是酸性氧化物却能跟HF作用
SiO2+4HF==SiF4↑+2H2O,此反应并不是因为HF的酸性,而是因为为常温下SiF4为气态物质,有利于反应正向进行,这是SiO2的突出特性,当然也是HF 的特性。
7.H2CO3的酸性强于H2SiO3。但却能发生如下反应:Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
强酸制备弱酸作为判断反应方向的依据,只适用于水溶液体系,而在非水溶液的条件下不一定适用,在高温下能发生反应:Na2CO3+SiO2 Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
2NaCl+H2SO4(浓) Na2SO4+2HCl↑
Na2SO4+2HCl↑
NaNO3+H2SO4(浓) NaHSO4+HNO3↑
NaHSO4+HNO3↑
上述两反应并不是由于H2SO4的强酸性,而是由于H2SO4为高沸点酸,HCl、HNO3为低沸点酸。
硅的用途:
高纯硅可作半导体材料,制造集成电路、晶体管、硅整流器等半导体器件,还可以制造太阳能电池。硅的合金用途也很广,如含硅4%的钢具有良好的导磁性,可用来制造变压器的铁芯;含硅15%左右的钢具有良好的耐酸性,可用来制造耐酸设备。
二氧化硅:
①化学式SiO2
②相对分子质量:60
③类别:酸性氧化物
④晶体类型:原子晶体
⑥晶体中粒子间的作用力:共价键
二氧化硅的物理性质和化学性质:
(1)物理性质:无色透明或白色粉末,原子晶体,熔沸点都很高,坚硬难熔,不溶于水,天然的二氧化硅俗称硅石,是构成岩石的成分之一。
(2)化学性质:不活泼
①不与水反应,不能跟酸(氢氟酸除外)发生反应。
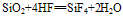 (氢氟酸不能盛放在玻璃容器中)。
(氢氟酸不能盛放在玻璃容器中)。②具有酸性氧化物的性质,能跟碱性氧化物或强碱反应。
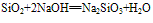 (实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
(实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
 (制玻璃)
(制玻璃)③具有弱氧化性


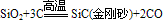
知识点拨:
二氧化硅晶体的结构若在硅晶体结构中的每个Si—Si键中“插入”一个氧原子,便可得到以硅氧四面体 (SiO4)为骨架的二氧化硅的结构,如图所示。在二氧化硅晶体里,硅原子和氧原子交替排列,不会出现Si—Si键和O—O键,即每个硅原子与四个氧原子形成四个共价键,每个氧原子与两个硅原子形成共价键,因此,二氧化硅晶体中硅原子和氧原子的个数比为1:2,二氧化硅的化学式为SiO2.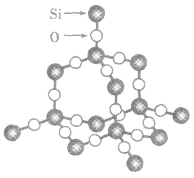
二氧化硅的用途:
①光导纤维的主要原料
②石英的主要成分是SiO2,纯净的石英可用来制造石英玻璃。石英晶体中有时含有其他元素的化合物,它们以溶解状态存在于石英中,呈各种颜色。纯净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。 水晶常用来制造电子工业中的重要部件、光学仪器,也用来制造高级工艺品和眼镜片。
③玛瑙石含有有色杂质的石英晶体,可用于制造精密仪器轴承,耐磨器皿和装饰品。
①化学式:SO2
②分子结构:SO2是由极性键形成的极性分子,因此易溶于水,其晶体为分子晶体。
二氧化硫的物理性质和化学性质:
1.物理性质:
SO2是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化(沸点-10℃)。
2.化学性质
(1)具有酸性氧化物的通性
①将SO2通入紫色石蕊试液中,试液变红。
②能与碱性氧化物、碱及某些盐反应。如:
(2)还原性 

(3)弱氧化性 
(4)漂白性(不能漂白酸碱指示剂) 能和某些有色物质化合生成无色物质,生成的无色物质不稳定,易分解而恢复原色,因此,SO2的漂白并不彻底。在中学化学常见试剂中,能用SO2漂白的只有品红溶液,品红溶液 无色溶液
无色溶液 恢复原色。
恢复原色。
SO2与一些物质反应的实验现象:


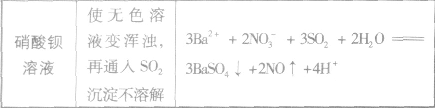
SO2与强碱反应后固体成分的确定:
SO2与强碱(如NaOH)溶液发生反应后的固体成分取决于二者的用量。遇到类似的问题,可以采用数轴分析法讨论。设SO2的物质的量为n(SO2),NaOH物质的量为n(NaOH),数轴代表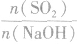 ,如下数轴所示:
,如下数轴所示: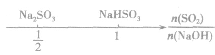
分析数轴可得:
(1)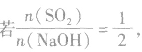 则固体物质为Na2SO3,
则固体物质为Na2SO3,
(2)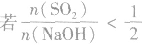 ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3.
(3)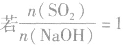 ,则同体物质为NaHSO3
,则同体物质为NaHSO3
(4)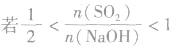 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3,
(5)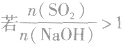 ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。
二氧化硫的制备:
工业制法:

实验室制法:
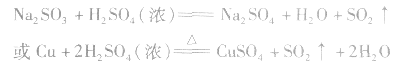
(1)收集:向上排空气法。
(2)检验:品红溶液。SO2是中学阶段学到的唯一种既能使品红褪色,加热后又能使其恢复原色的气体。
(3)尾气处理:用NaOH溶液吸收。
二氧化硫的用途:
工业上用二氧化硫漂白纸浆、毛、丝、草编制品等。此外,二氧化硫还可用于杀菌消毒,可以用作防腐剂。
二氧化硫对环境的污染及治理:

传统无机非金属材料:
| 硅酸盐产品 | 水泥 | 玻璃 | 陶瓷 |
| 主要设备 | 水泥回转窑 | 玻璃熔炉 | |
| 原料 | 石灰石、石膏和黏土 | 纯碱、石灰石、石英 | 黏土 |
| 反应原理 | 复杂的物理,化学变化 | Na2CO3+SiO2 Na2SiO3+CO2↑ Na2SiO3+CO2↑CaCO3+SiO2  CaSiO3+CO2↑ CaSiO3+CO2↑ |
复杂的物理,化学变化 |
| 主要成分 | 2CaO·SiO2 3CaO·SiO2 3CaO·Al2O3 |
Na2O·CaO·6SiO2 | |
| 特性 | 水硬性 | 非晶体、无固定熔点,在一定温度范围内软化可制成各种形状 | 抗氧化、抗酸碱腐蚀、耐高温、绝缘 |
| 共同特点 | ①都用含硅的物质作原料 ②反应条件都是高温 ③都发生复杂的物理、化学变化 ④冷却后都生成成分复杂的硅酸盐 | ||
几种玻璃的特性和用途:
| 种类 | 特性 | 用途 |
| 普通玻璃 | 熔点较低 | 窗玻璃、玻璃瓶等 |
| 石英玻璃 | 膨胀系数小、耐酸碱、强度大、滤光 | 化学仪器;高压水银灯、紫外灯的灯壳等 |
| 光学玻璃 | 透光性能好、有折光和色散性 | 眼镜片;照相机、显微镜、望远镜用凹凸透镜等光学仪器 |
| 玻璃纤维 | 耐踌蚀、不怕烧、不导电、不吸水、隔热、吸声、防虫蛀 | 太空飞行员的衣服等 |
| 钢化玻璃 | 耐高温、耐腐蚀、强度大、质轻、抗震裂等 | 运动器材;汽车、火车窗玻璃等 |
| 有色玻璃 | 加入金属氧化物 红色:Cu2O 蓝色:Co2O3 |
工艺品、窗玻璃等 |
无机非金属材料:
1.无机非金属材料的分类:

2.无机非金属材料的定义:
最初,无机非金属材料主要是指硅酸盐材料,所以,硅酸盐材料也称为传统无机非金属材料。随着科学和生产技术的发展,以及人们生活的需要,一些具有特殊结构、特殊功能的新材料被相继研制出来,如半导体材料、超硬耐高温材料、发光材料等,我们称这些材料为新型无机非金属材料。
与“下列说法中不正确的是( )A.制普通玻璃的原料主要是纯碱、...”考查相似的试题有:
- 一定温度下,饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来的温度。下列叙述中不合理的是A.钠浮于液面,到处游动,...
- 下列实验与物质微粒大小无直接关系的是
- 下列有关说法正确的是[ ]A.1H、D+、T2互为同位素B.H2O、CH3COOH、NH4HCO3都是电解质C.饱和氯化铁溶液、淀粉溶液、牛奶都属...
- 纳米材料在工农业生产和日常生活中应用越来越广,下列分散系中分散质粒子直径与纳米粒子具有相同数量级的是 A.溶液B.胶体C...
- 下列说法中错误的是[ ]A.在卤素单质中沸点最低,在碱金属单质中熔点最高B.在氯化钠晶体中每个同时吸收8个,每个同时吸引8个...
- 下列说法正确的是( )A.Si是一种非金属主族元素,其晶体可用于制作计算机芯片B.工业上通常用电解Na、Fe、Cu对应的氯化物制...
- 硅酸的工业制法是:将稀释好的硅酸钠和硫酸反应生成水凝胶,经水洗与干燥得到成品。有关反应的化学方程式是________ _____
- 下列有关实验的叙述中,合理的是( )①用pH试纸测得氯水的pH为2 ②不宜用瓷坩埚灼烧氢氧化钠固体③使用容量瓶的第一步操作是先...
- 向含有FeCl3、BaCl2的酸性溶液中通入SO2气体会有沉淀产生,该沉淀是[ ]A.BaSO4B.FeSC.BaSO3D.S
- 2008年奥运会金牌背面镶嵌着白玉,白玉的化学式可用CaxMgySipO22(0H)2表示(也可用Ca、Mg、Si、H的氧化物表示).(1)取8....