本试题 “分类法是一种行之有效、简单易行的科学方法。下列分类中不正确的是[ ]A.氧单质--氧气、臭氧B.构成物质微粒--分子、原子C.有机化合物--甲烷、乙醇D.常见的...” 主要考查您对构成物质的微粒(分子、原子、离子)
单质和化合物
有机化合物和无机化合物
酸、碱、盐
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 构成物质的微粒(分子、原子、离子)
- 单质和化合物
- 有机化合物和无机化合物
- 酸、碱、盐
构成物质的微粒:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
分子和原子的比较:
原子与离子的比较:
分子、原子、离子是构成物质的基本微粒。
分子,原子,离子的比较:
| 分子 | 原子 | 离子 | |
| 概念 | 保持物质化学性质的最小粒子 | 是化学变化中的最小粒子 | 带电的原子或原子团 |
| 表示方法 | 用化学式表示. 如H2,He | 用元素符号表示,如H,Fe | 用离子符号表示,如Na+、NO3- |
| 微粒的运动 | 物理变化是分子运动的结果,如:水的蒸发 | 化学变化是原子运动的结果. 如:水的电解 | 离子运动的结果可能是物理变化。也可能是化学变化,如:NaCl的溶解是物理变化, NaCl与AgNO3反应是化学变化 |
| 化学计量数与符号的关系 | 化学式、元素符号、离子符号前加上化学计量数,如2H,2H2,3Na+,只表示原子、分子、离了的“个数”,不表示元素和物质 | ||
| 联系 |  | ||
分子和原子的比较:
| 原子 | 分子 | |
| 定义 | 化学变化中的最小粒子 | 保持物质(由分子直接构成的物质)化学性质的最小粒子 |
| 相同点 | ①都是构成物质的基本粒子,有些物质是由分子构成的.有些物质是由原子直接构成的; ②都很小,但者阶一定的体积和质量; ③都在不断地运动; ④微粒子间都有间隔; ⑤都能保持物质的化学性质 | |
| 区别 | 化学变化中不能再分 | 化学变化中可以再分 |
| 如:在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子 | ||
| 同种原子具有相同的质子数 | 同种分子化学性质相同 | |
| 联系 | 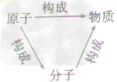 | |
原子与离子的比较:
| 原子 | 离子 | |
| 概念 | 化学变化中最小粒子 | 带电荷的原子或原子团 |
| 电性 | 呈电中性,不带电 | 带电: 阳离子带正电 阴离子带负电 |
| 表示方法 | 用元素符号表示;Na 表示钠原子,2Na表示2个钠原子 | 在元素符号右上角先写电荷数,后标出电性 (+、-):Na+表示钠离子,2Na+表示2个钠离子 |
| 数量关系 | 核内质子数=核外电子数 | 阳离子:核内质子数> 核外电子数 阴离子:核内质子数< 核外电子数 |
| 相似点 | 都是构成物质的一种粒子 | |
| 转化 |  | |
单质:
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
化合物与氧化物的区别和联系:
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
| 单质 | 化合物 | ||
| 区别 | 宏观组成 | 同种元素 | 不同种元素 |
| 微观构成 | 有同种原子构成 | 由不同种原子构成 | |
| 化学性质 | 不能发生分解反应 | 一定条件下发生分解反应 | |
| 联系 | 相互转变 | 它们均属于纯净物。单质发生化合反应可以生成化合物,化合物发生分解反应可以生成单质 | |
| 质子数 | 同一种元素的原子,不论在一单质里还是在化合物里,原子核内质子数保持不变 | ||
化合物与氧化物的区别和联系:
| 化合物 | 氧化物 | |
| 区别 | ①由不同种元素组成的纯净物叫化合物 ②由两种或两种以上元素组成 ③不一定含有氧元素 ④属于纯净物中的一类 |
①由两种元素组成的化合物中,如果有一种元素是氧元素,这种化合物叫氧化物 ②一定由两种元素组成 ③一定含有氧元素 ④属于化合物中的一类 |
| 联系 | 氧化物和化合物是个体与总体的关系,氧化物属于化合物中的一类 | |
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
共价化合物与离子化合物的区别:
1. 共价化合物
(1)概念:像HCl、CO2这样以共用电子对结合在一起的化合物为共价化合物。
(2)共价化合物的类型:
①两种非金属原子结合成的化合物,如HCl、CO2等。
②非金属与酸根构成的化合物,如H2SO4、HNO3等。
2. 离子化合物与共价化合物的区别:
离子化合物是由阴、阳离子相互作用形成的化合物;共价化合物是原子间全部以共用电子对结合形成的化合物。离子化合物由离子构成,共价化合物大多数由分子构成。
有机化合物:
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
有机化合物与无机化合物的主要区别:
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
氧化物,酸,碱,盐的比较:
| 物质类别 | 概念 | 分类 |
| 氧化物 | 由两种元素组成,期中一种是氧元素 | 金属氧化物:由金属元素与氧元素组成,如MgO,Fe2O3等 非金属氧化物:由非金属元素与氧元素组成,如CO2、SO2、H2O等 |
| 酸 | 能离解成氢离子和酸根离子的化合物 | 含氧酸:如H2SO4、H2CO3、HNO3等无氧酸:如HCl,H2S等 |
| 碱 | 由金属离子和氢氧根离子构成的化合物 | 可溶性碱:如NaOH,Ca(OH)2等不溶性碱:如Mg(OH)2、 Fe(OH)3等 |
| 盐 | 由金属离子(或铵根离子)和酸根离子构成的化合物 | 正盐:如NaCl、NH4Cl、Na2CO3,仅由金属离子或钱根离子和酸根离子两部分组成酸式盐:如NaHCO3、NH4HCO3,由金属离子或铵根离子、酸式酸根离子构成碱式盐;如Cu2(OH)2CO3,由金属离子、酸根离子和氢氧根离子构成 |
有机化合物与无机化合物的主要区别:
| 有机化合物 | 无机化合物 | |
| 溶解性 | 多数不溶于水。易溶于有机溶剂 | 有些溶于水而不溶于有机溶剂 |
| 耐热性 | 多数不耐热。熔点较低,一般在400℃ 以下 | 多数耐热,难熔化,熔点一般比较高 |
| 可燃性 | 多数可以燃烧 | 多数不能燃烧 |
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
酸:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
| 从化学组成看 | 从电离观点看 | 组成特点 | |
| 酸 | 由氢元素和酸根组成 | 电离时生成的阳离子全都是氢离子(H+)的化合物 | 一定含氢元素 |
| 碱 | 由金属元素和氢氧根组成(氨水也是碱) | 电离时生成的阴离子全都是氢氧根离子(OH-)的化合物 | 一定含氢、氧 元素 |
| 盐 | 含有金属元素(或NH4+) 和酸根 | 电离时能生成金属离子(或NH4+)和酸根离子的化合物 | 酸式盐中一定含氢元素,碱式盐中一定含氢、氧元素 |
发现相似题
与“分类法是一种行之有效、简单易行的科学方法。下列分类中不正...”考查相似的试题有:
- 沈阳是2008年北京奥运会足球比赛的分赛场之一.兴奋剂检测是对足球运动员的一项重要检测.诺龙是兴奋剂中的一种,其化学式是C...
- 化学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如136C表示核内有6个质子和7...
- 下列常见物质中,属于纯净物的是A.蒸馏水B.粗盐C.酱油D.食醋
- 纯净的水是( )A.单质B.混合物C.非金属D.化合物
- 下列叙述中,正确的是( )A.某物质只含有一种元素,但它不一定是单质B.N5是一种新型的化合物C.含有氧元素的化合物都是氧...
- 臭氧层是地球的保护伞,臭氧(O3)属于( )A.单质B.化合物C.氧化物D.混合物
- 乙烯具有促进果实成熟的作用,还是合成纤维、橡胶、塑料的基本化工原料。乙烯无色,不溶于水,密度比空气小,化学式为C2H4,...
- 下列物质分类中错误的一组是[ ]A.单质 Fe、 S、 N2B.氧化物 H2O、 P2O5、 Al2O3C.酸 HCl、 H2SO4、 NH4H2PO4D.碱 KOH、 M...
- 用“>”“<”“≥”“≤”“=“等符号填空:(1)某含氧化合物A所含元素的种类______某氧化物B所含元素的种类.(2)化学反应前元素的种...
- 中央电视台《幸运52》你看过吗?现在就试试吧!请根据各组的提示,写出(1)~(5)中的空白项: 物质分类名称或俗名性质用途...