本试题 “过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.对于下列A~F涉及H2O2的反应,回答相关问题:A.Na2O2+2HCl=2NaCl...” 主要考查您对氧化还原反应的本质和特征
氧化还原反应的配平
氧化性、还原性强弱的比较
氧化还原反应的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化还原反应的本质和特征
- 氧化还原反应的配平
- 氧化性、还原性强弱的比较
- 氧化还原反应的定义
电子的转移(得失或偏移)
氧化还原反应的特征:
化合价升降(某些元素化合价在反应前后发生变化,是氧化还原反应判别的依据)
氧化还原反应的发展史:
- 物质与氧气发生的反应属于氧化反应,含氧化合物中氧被夺去的反应属于还原反应。
- 有化合价升降的反应属于氧化还原反应。
- 有电子得失或偏移的反应属于氧化还原反应。
对物质的认识存在发展的过程,从最初的隔离开的氧化反应、还原反应,到从表面上看化合价变化的氧化还原反应,把氧化与还原统一在一个概念下,再透过现象看本质,化合价的变化是有电子得失或偏移引起的。
氧化还原反应中应注意的几个问题:
1、氧化剂氧化性的强弱,不是看得电子的多少,而是看得电子的难易;
还原剂还原性的强弱,不是看失电子的多少,而是看失电子的难易。
eg:氧化性:浓HNO3>稀HNO3还原性:Na>Al
2、有新单质参加或生成的反应不一定是氧化还原反应 eg:C(金刚石)==C(石墨);3O2==2O3(放电);P4(白磷)==4P(红磷)
3、任何元素在化学反应中,从游离态变为化合态,或由化合态变为游离态,均发生氧化还原反应(比如置换反应,化合反应,分解反应)
4、置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
5、元素具有最高价的化合物不一定具有强氧化性! eg.H3PO4、H2SiO3(或H4SiO4)两酸均无强氧化性但硝酸有强氧化性。
氧化还原的表示可用单线桥也可用双线桥:
一、双线桥法:
此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原关系。双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团。
标变价 明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
连双线 将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素)
标得失 1.标电子转移或偏离数 明确标出得失电子数,格式为“得/失发生氧化还原反应原子个数×单位原子得失电子数”
2.标化合价变化 一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
3.标出元素反应类型 一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
4.检查得失电子守恒 检查得失电子数是否相等,如不相等则重新分析。
例如: 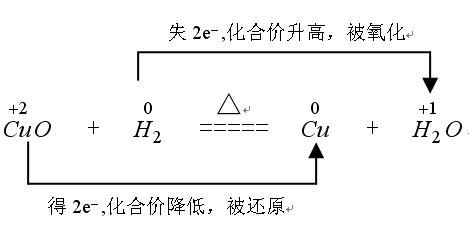
二、单线桥法:
在氧化还原反应中,有电子发生转移(得失或偏移),也就是在反应物中有元素电子发生得失或偏移,这时用一条带箭头的曲线从失去电子的元素指向得到电子的元素,并在“桥”上标出转移的电子数,这种表示方法叫单线桥法。
(1)标价态明确标明发生氧化还原反应的元素的化合价
(2)连单线连接方程式左边的氧化剂与还原剂,箭头一律指向氧化剂
(3)不注得失标出转移的电子的总数,这里不用像双线桥那样,仅需直接标出电子总数
例如: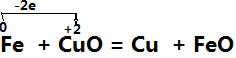
注意事项:
(1)不得标明"得"或"失",否则是错的
(2)箭头表示电子转移的方向,指向氧化剂注意:为了规范起见,单线桥法最好不用于自身氧化还原的反应,因为那样标记会使反应中的电子去向不明确,故在自身氧化还原的反应方程式中最好用双线桥法表示电子转移。
配平简介:
化学反应方程式严格遵守质量守恒定律,书写化学反应方程式写出反应物和生成物后,往往左右两边各原子数目不相等,不满足质量守恒定律,这就需要通过配平来解决。
配平原则:
(1)电子守恒原则:反应中还原剂失去电子的总数与氧化剂得到电子的总数相等
(2)电荷守恒原则:若为离子反应,反应前后离子所带正负电荷总数相等
(3)质量守恒原则:反应前后各元素的原子个数相等
配平步骤:
(1)一标:标明反应前后化合价有变化的元素的化合价
(2)二等:通过求最小公倍数使化合价升降总值相等
(3)三定:确定氧化剂与还原剂的化学计量数
氧化剂(还原剂)化学计量数=降(升)价的最小公倍数÷1mol氧化剂(还原剂)降(升)价总数
(4)四平:用观察法配平其他物质的化学计量数
(5)五查:检查质量与电荷、电子是否分别守恒
配平技巧:
(1)逆向配平法:部分氧化还原反应、自身氧化还原反应等可用逆向配平法,即选择氧化产物、还原产物为基准物来配平(一般从反应物很难配平时,可选用逆向配平法)
例:
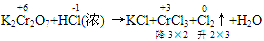
通过表明氧化产物、还原产物化合价的升降,确定CrCl3、Cl2的计量数为2和3,然后再用观察法配平。
(2)设“1”配平法:设某一反应物或生成物(一般选用组成元素较多的物质作基准物)的化学计量数为1,其余各物质的化学计量数可根据原子守恒原理列方程求得。
例:P4O+Cl2→POCl3+P2Cl6
可令P4O前的系数为1,Cl2的系数为x,则
1P4O+xCl2→POCl3+3/2P2Cl6 ,再由Cl原子守恒得2x=3+3/2×6 得x=6 即可配平
(3)零价配平法:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降总数相等,最后用观察法配平其他物质的化学计量数。
例:Fe3C+HNO3=Fe(NO3)3+CO2↑+NO2↑+H2O
复杂化合物Fe3C按照常规方法分析,无法确定其Fe和C的具体化合价,此时可令组成物质的各元素化合价为零价,根据化合价升降法配平。
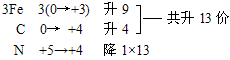
再用观察法确定物质的化学计量数。
(4)整体标价法:当某元素的原子在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零原则予以整体标价。
例:S+Ca(OH)2→CaSx+Ca2S2O3+H2O
生成物CaSx、Ca2S2O3中的Sx、S2作为一个整体标价为-2、+4价,则化合价升降关系为:
Sx 0→-2 降2×2
S2 0→+4 升4×1
即可配平。
(5)缺项配平法:一般先确定氧化剂、还原剂、氧化产物、还原产物的化学计量系数,再通过比较反应物与生成物,确定缺项(一般为H2O、H+或OH-),最后观察配平。
(6)有机氧化还原反应的配平:有机物中元素的化合价一般来讲,氢元素显+1价,氧元素显-2价,然后再根据化合价的代数和为零求酸碳元素的平均化合价。
氧化还原反应方程式配平的一般方法与步骤:
- 一般方法:从左向右配。
- 步骤:标变价,找变化,求总数,配系数。
- 标出元素化合价变化的始态和终态
- 求升价元素或降价元素化合价的变化数
- 求化合价变化数的最小公倍数,分别作为氧化剂或还原剂的系数
- 配平变价元素
- 用观察法配平其他元素
- 检查配平后的方程式是否符合质量守恒定律(离子方程式还要看电荷是否守恒)
如: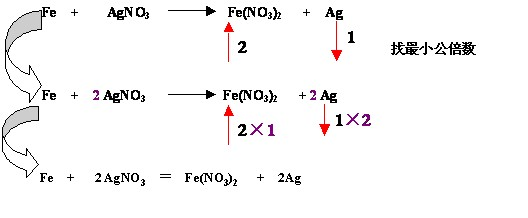
特殊技巧:
配平时若同一物质内既有元素的化合价上升又有元素的化合价下降,若从左向右配平较困难,可以采用从右向左配平,成为逆向配平法。
氧化还原反应:
有电子转移(得失或偏移)的反应;(无电子转移(得失或偏移)的反应为非氧化还原反应)
反应历程:
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
氧化还原反应中存在以下一般规律:
强弱律:氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化还原性的强弱判定:
物质的氧化性是指物质得电子的能力,还原性是指物质失电子的能力。物质氧化性、还原性的强弱取决于物质得失电子的能力(与得失电子的数量无关)。从方程式与元素性质的角度,氧化性与还原性的有无与强弱可用以下几点判定:
(1)从元素所处的价态考虑,可初步分析物质所具备的性质(无法分析其强弱)。最高价态——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低价态,只有还原性,如Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe、S、SO2等。
(2)根据氧化还原的方向判断:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(3)根据反应条件判断:当不同的氧化剂与同一种还原剂反应时,如氧化产物中元素的价态相同,可根据反应条件的高、低进行判断,如是否需要加热,是否需要酸性条件,浓度大小等等。
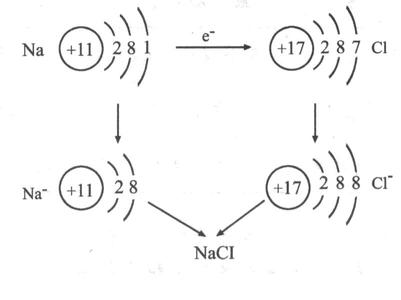
电子的得失过程:

其过程用核外电子排布变化情况可表示为:
与“过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利...”考查相似的试题有:
- 下列反应中,水既不做氧化剂又不做还原剂但属于氧化还原反应的是( )A.2Na+2H2O═2NaOH+H2↑B.2F2+2H2O═4HF+O2C.2Na2O2+2H2...
- I.根据下列化学方程式回答问题:SiO2+2C+2Cl2△.SiCl4+2CO(1)反应中电子转移的数目是______.(2)在该反应中,还原剂是___...
- 在一定条件下,等物质的量的氯气与碘单质反应,得到一种红棕色液体ICl,ICl有很强的氧化性.现有下列两个反应:①2ICl+2Zn=ZnC...
- 同位素示踪法是用同位素作为一种标记,制成含有同位素的标记化合物代替相应的非标记化合物进行化学反应,然后用核探测器随时...
- 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是A.x=0.4a,...
- 一定浓度l00mL的HNO3溶液中加入2.8gFe,全部溶解,得到标准状况下的NO气体1.12L, 测得反应后溶液中的c(H+)=0.1mol/L。若反...
- 下列反应中,盐酸作为氧化剂的是( )A.Zn+2HCl====ZnCl2+H2↑B.FeS+2HCl====FeCl2+H2S↑C.NH3+HCl====NH4ClD.MnO2+4HClMnCl2...
- (14分)Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W原子最外层电子数与核外电子总数之比为3∶4...
- NH4CuSO3为难溶于水的白色固体,但与足量的质量分数50%的硫酸混合微热,生成红色固体物、产生有刺激性气味的气体和蓝色溶液....
- 根据表中信息判断,下列选项不正确的是( )序号反应物产物①KMnO4、H2O2、H2SO4K2SO4、MnSO4 ②Cl2、FeBr2FeCl3、FeBr3③MnO4-C...