本试题 “将3mol A和2.5mol B混合于2L的密闭容器中,发生反应的化学方程式为:3A(气)+B(气)xC(气)+2D(气),5min后反应达到平衡状态,容器内的压强变小,已知D...” 主要考查您对化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学平衡的有关计算
化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
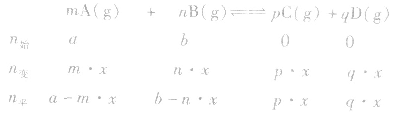
则有:

(2)对于反应物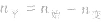 ,对于生成物
,对于生成物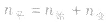
(3)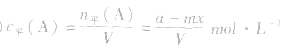
(4)A的转化率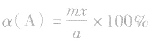
(5)平衡时A的体积(物质的量)分数
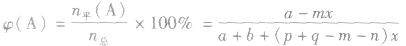
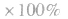
(6)
(7)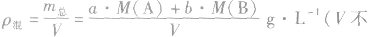
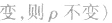
(8)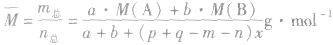
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
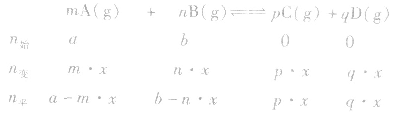
则有:

(2)对于反应物
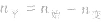 ,对于生成物
,对于生成物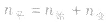
(3)
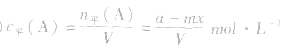
(4)A的转化率
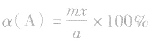
(5)平衡时A的体积(物质的量)分数
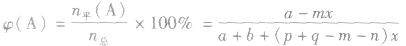
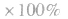
(6)

(7)
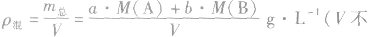
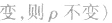
(8)
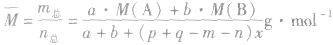
发现相似题
与“将3mol A和2.5mol B混合于2L的密闭容器中,发生反应的化学方...”考查相似的试题有:
- 在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙...
- 氮化硅(Si3N4)是一种新型陶瓷材料,它可通过以下反应制得:3SiO2+ 6C + 2N2 Si3N4+ 6CO,有关说法不正确的是 ( )A....
- 2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0...
- .下列事实不能用勒夏特列原理解释的是( )A.打开汽水瓶时,有大量气泡溢出B.对2HI(g)H2(g) + I2(g),增大平衡体系压强可...
- 工业上可以利用反应CH4(g)+H2O(g)CO(g)+3H2(g)制备化工原料CO和H2。(1)一定条件下,向体积为1L的密闭容器中充入0.20molCH4和0...
- 已知可逆反应CO(g)+H2O(g)CO2(g) + H2(g),(1)写出该反应的化学平衡常数表达式:K=__________。(2)830K时,若起始时:C(C...
- 已知反应 2NH3N2+ 3H2,在某温度下的平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N2+ 3/2 H2NH3的平衡常数为A.4B.2...
- 工业制硝酸的其中一步反应为氨的氧化,反应方程式为:4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g)△H<0。有关该反应的说法正确...
- 在密闭容中发生下列反应aA(g)cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平...
- 某条件下,在2 L密闭容器中发生如下反应2NO2(g)2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO...